MORIMOTO RESERACH GROUP (SYNTHETIC ORGANIC CHEMISTRY LABORATORY)
TEL.06-6605-3141
〒558-8585 大阪府大阪市住吉区杉本3-3-138
発表活動PUBLICATIONS and PRESENTATIONS
SELECTED PUBLICATIONS
西川 慶祐 ( 講師 ) の論文リストはこちらです。"Total Synthesis of a Marine Bromotriterpenoid Isodehydrothyrsiferol" K. Nishikawa, Y. Morimoto In Modern Natural Product Synthesis – Overcoming Difficulties, Eds. by M. Nakada, K. Tanino, K. Nagasawa, S. Yokoshima, Springer Nature, 479-502 (2024).
ABSTRACT : The thyrsiferol family natural products are marine triterpene polyethers biogenetically derived from squalene and structurally characterized by a bromine atom and some six- and five-membered ethereal rings. Their stereostructures cannot easily be determined by modern spectroscopic analysis, because there are acyclic tetrasubstituted chiral centers and the remote stereoclusters. In these cases, asymmetric total synthesis demonstrates its power. Herein, to determine the entire stereostructure of the thyrsiferol family member isodehydrothyrsiferol, isolated from the red alga Laurencia viridis, the asymmetric total synthesis has been performed. The key steps are the convergent and effective synthetic strategy using a Suzuki–Miyaura cross-coupling, a one-pot construction of the tetrahydropyranyl C ring via a stoichiometric Katsuki-Sharpless asymmetric epoxidation and 6-exo oxacyclization in situ promoted by Ti chelation, and 6-endo bromoetherification for the A ring formation. Through the enantioselective total synthesis, we have accomplished complete assignment of the entire stereostructure for isodehydrothyrsiferol and found the absolute configuration of the ABC ring system is opposite to that common to the other congeners from the same red algae. In addition, such enantiodivergency also occurred between dehydrothyrsiferol and isodehydrothyrsiferol originating from the identical red alga Laurencia viridis. There are no these findings without asymmetric total synthesis.

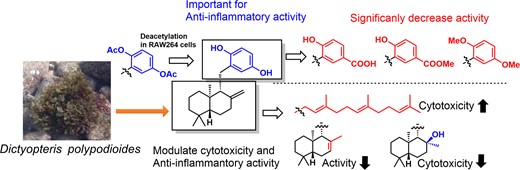
"Structure-Activity Relationship of Anti-Inflammatory Meroterpenoids Isolated from Dictyopteris polypodioides in RAW264 Cells" M. Kumagai, A. Matsuda, N. Shiiba, T. Tsuruta, H. Endo, K. Nishikawa, and Y. Morimoto Biosci. Biotech. Biochem. 88, 594–600 (2024).
ABSTRACT : In this study, we explored anti-inflammatory compounds from the brown alga Dictyopteris polypodioides and isolated 7 meroterpenoids. Their anti-inflammatory activities were evaluated using the lipopolysaccharide (LPS)-stimulated mouse macrophage cell line, RAW264. Yahazunol (1) exhibited similar nitric oxide (NO) production inhibitory activity as zonarol (2), which has previously been shown to be an anti-inflammatory compound. Yahazunol (1), zonarol (2), and isozonarol (3) inhibited not only nitric oxide production but also inducible nitric oxide synthase (iNOS), interleukin-6 (IL6), and C-C motif chemokine ligand 2 (CCL2) mRNA expression in RAW264 cells. The structure-activity relationships of the 11 compounds, including their synthetic analogs, revealed the significance of the hydroquinone moiety in the anti-inflammatory activity of these sesquiterpenoids in RAW264 cells. Diacetylated zonarol (9) exhibited an activity comparable to that of zonarol as a result of intracellular deacetylation. These results provide new insights into the anti-inflammatory activity of hydroquinone-containing natural products.
"Halogenated Cyclic Monoterpenoids with Anti-biofouling Activity from the Okinawan Red Marine Algae Portieria hornemannii" S. Ishigami, R. Fukada, G. Nagasaka, T. Tsuruta, K. Nishikawa, Y. Sasaki, K. Nimura, I. Oshima, Y. Yamagishi, Y. Morimoto, T. Kamada, and T. Ishii Chem. Biodivers. 21, e202400436 (2024).
ABSTRCT : The red algal genus Portieria is a prolific producer of halogenated monoterpenoids. In this study, we isolated and characterised monoterpenoids from the Okinawan red algae Portieria hornemannii. A new polyhalogenated cyclic monoterpenoid, 2(R)-chloro-1,6(S)-dibromo-3(8)(Z)-ochtoden-4(R)-ol (1), along with three known monoterpenoids, (2R,3(8)E,4S,6R)-6-bromo-2-chloro-1,4-oxido-3(8)-ochtodene (2), 1-bromo-2-chloroochtoda-3(8),5-dien-4-one (3), and 2-chloro-1-hydroxyochtoda-3(8),5-dien-4-one (4) were isolated from the methanol extract of three populations of P. hornemannii. These compounds were characterised using a combination of spectroscopic methods and chemical synthesis, and the absolute stereochemistry of compounds 1 and 2 was determined. In addition, all isolated compounds were screened for their anti-biofouling activity against the mussel Mytilus galloprovincialis, and 1 exhibited strong activity. Therefore, halogenated monoterpenoids have the potential to be used as natural anti-biofouling drugs.

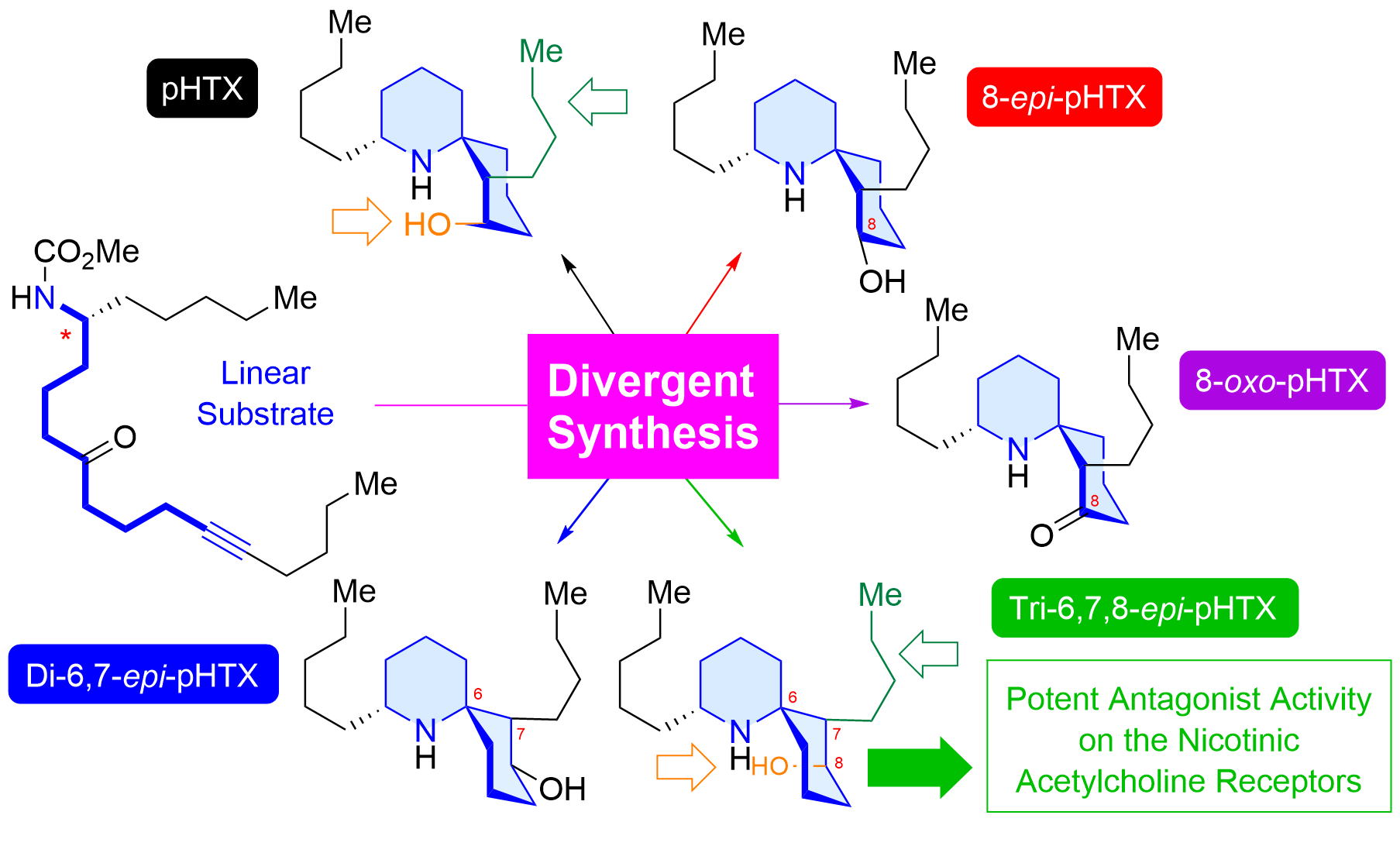
"Divergent Nine-Step Syntheses of Perhydrohistrionicotoxin Analogs and Their Inhibition Activity Toward Chicken α4β2-Neuronal Nicotinic Acetylcholine Receptors" K. Nishikawa, Y. Ono, S. Mori, K. Takayama, M. Ihara, K. Matsuda, and Y. Morimoto J. Org. Chem. 89, 4128-4133 (2024).
ABSTRACT : Histrionicotoxin (HTX) alkaloids, which are isolated from Colombian poison dart frogs, are analgesic neurotoxins that modulate nicotinic acetylcholine receptors (nAChRs) as antagonists. Perhydrohistrionicotoxin (pHTX) is the potent synthetic analogue of HTX and possesses a 1-azaspiro[5.5]undecane skeleton common to the HTX family. Here, we show for the first time the divergent nine-step synthesis of pHTX and its three stereoisomers from the known aldehyde through a one-step construction of the 1-azaspiro[5.5]undecane framework from a linear amino ynone substrate. Surprisingly, some pHTX diastereomers exhibited antagonistic activities on the chicken α4β2-neuronal nAChRs that were more potent than pHTX.
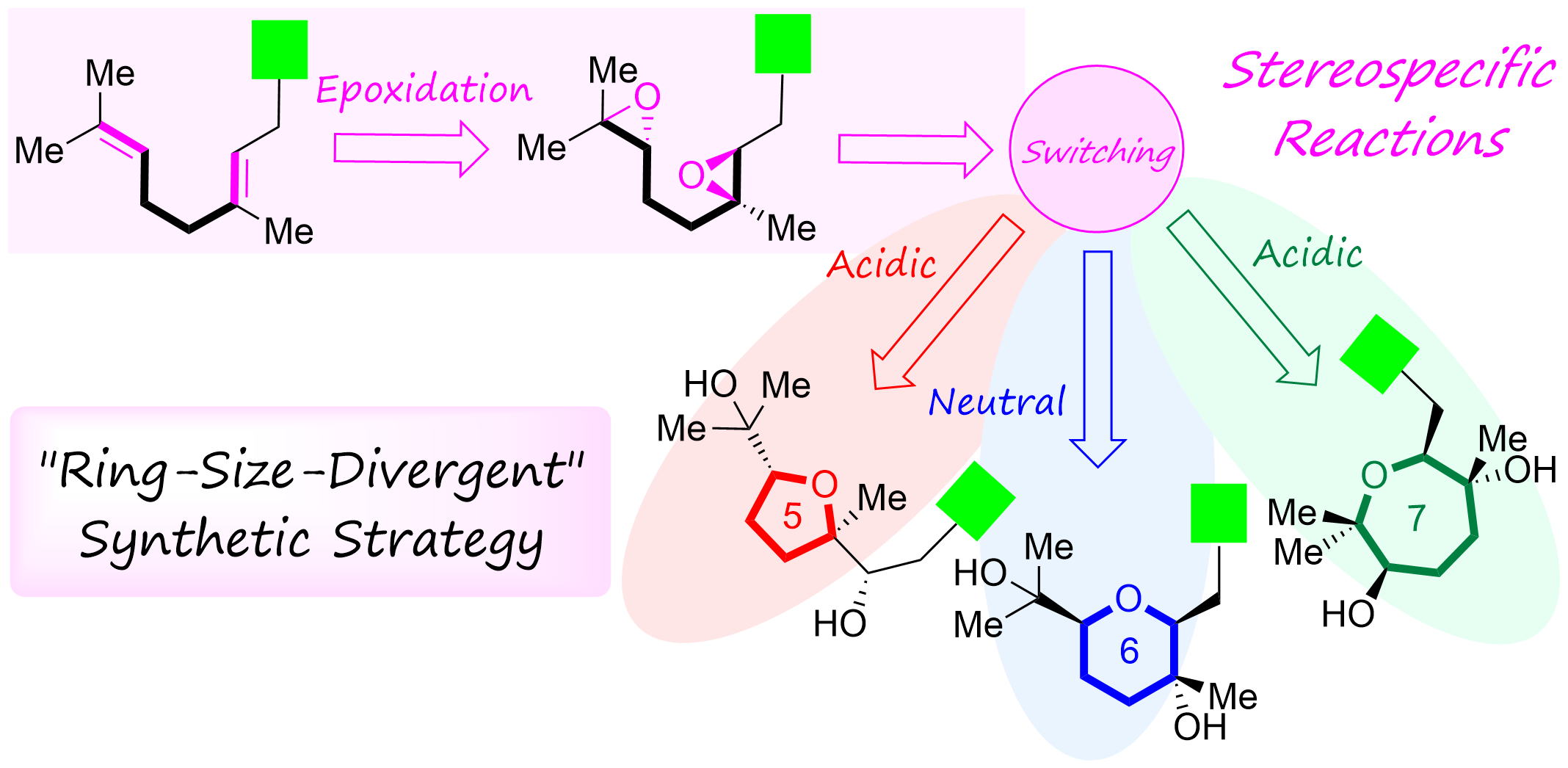
"Establishment of “Ring-Size-Divergent” Synthetic Strategy: Divergent Synthesis, Stereochemical Assignments, and Biological Activity Studies of Nerolidol-Type Sesquiterpenoids and Feroniellins" K. Nishikawa, T. Teranishi, T. Tsuruta, T. Niwa, K. Morita, S. Hashimoto, A. Hoshino, M. Kumagai, and Y. Morimoto J. Org. Chem. 88, 15844-15861 (2023).
ABSTRCT: Biomimetic epoxide-opening cascade cyclizations of polyepoxides enable the efficient and rapid construction of polyether skeletons. In this study, we discovered a method for switching the cyclization mode from tetrahydrofuran to tetrahydropyran (THP) formation in epoxide-opening cascades of polyepoxides. The THP formation proceeded via an epoxonium-ion intermediate by simple heating in neutral water. Next, by expanding the switching reaction, we successfully established a “ring-size-divergent” synthetic strategy that enabled the synthesis of the five-, six-, and seven-membered ether rings from identical diepoxide cyclization precursors under simple acidic or neutral conditions. The “ring-size-divergent” synthetic strategy was applied to the short divergent synthesis of nerolidol-type sesquiterpenoids and feroniellins, resulting in the revision of the proposed stereochemistry of certain natural products and the determination of all of the absolute configurations. Additionally, the anti-inflammatory activities of the synthetic samples were evaluated.
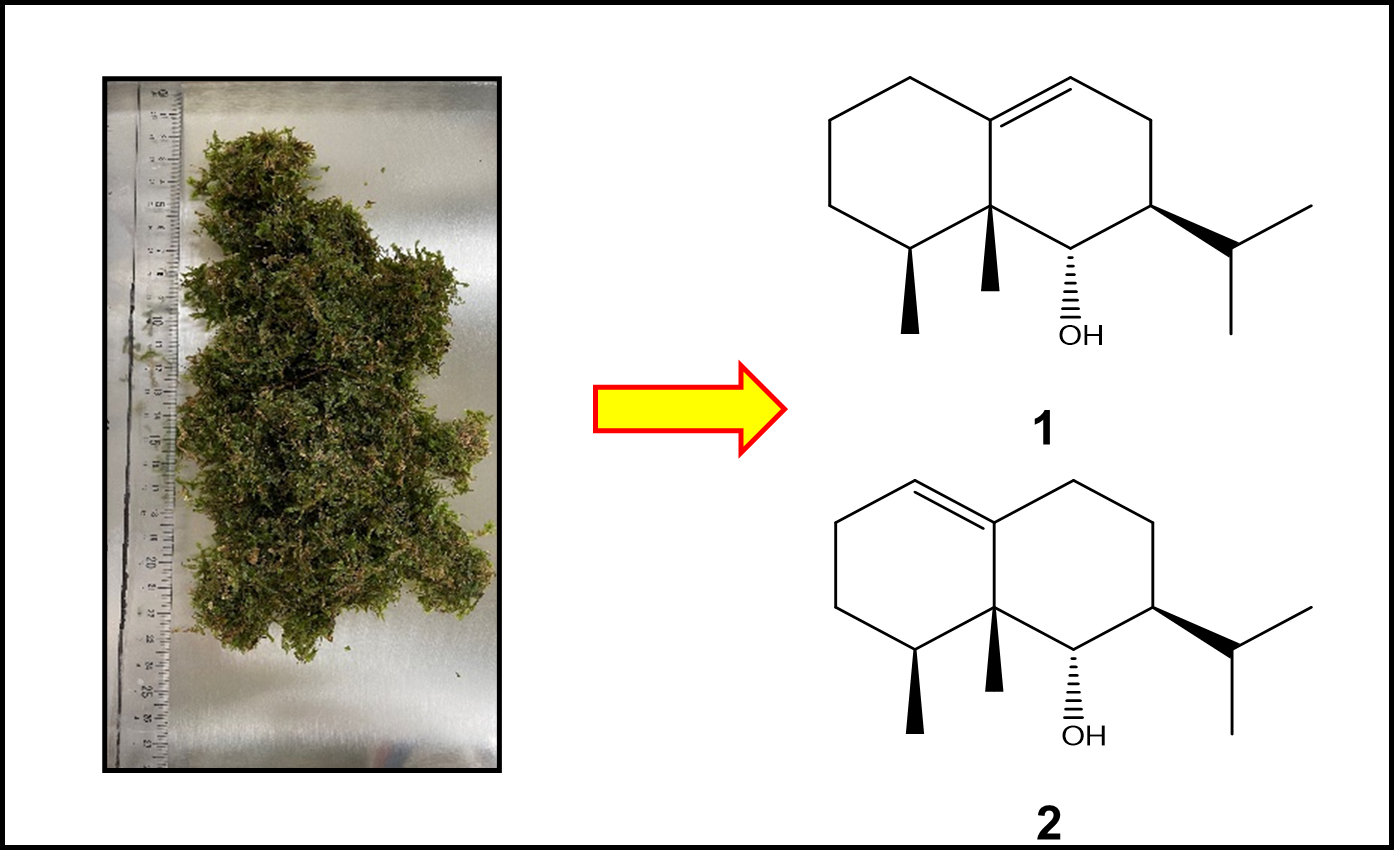
"Two New Eremophilane-Type Sesquiterpenoids from Japanese Liverwort Bazzania japonica" R. Fukada, J. Kawano, T. Tsuruta, T. Nonaka, K. Sato, S. Miyazawa, S. Ishigami, T. Ishii, K. Nishikawa, Y. Asakawa, and T. Kamada Chem. Biodivers. 20, e20230013 (2023).
ABSTRACT: Two new eremophilane-type sesquiterpenoids, fusumaols A (1) and B (2), were isolated from the stem-leafy liverwort, Bazzania japonica collected in Mori-Machi, Shizuoka, Japan. Their structures were established using extensive spectroscopic (IR, MS, and 2D NMR) data, and the absolute configuration of 1 was determined by the modified Mosher's method. This is the first time eremophilanes have been discovered in the liverwort genus Bazzania. Compounds 1 and 2 were evaluated for their repellent activity against the adult population of the rice weevil Sitophilus zeamais using the modified filter paper impregnation method. Both sesquiterpenoids showed moderate repellent activities.

"ヨウ化サマリウムによるバービアー型環化反応を鍵工程とするトキシコデナン類の不斉全合成: 糖尿病性腎症の低分子創薬シード分子の探索 ( Asymmetric Total Synthesis of Toxicodenanes by the Samarium Iodide-Induced Barbier-Type Cyclization Reaction as a Key Step: Seeking of Seed Compounds for the Small Molecule Drug Discovery of Diabetic Nephropathy )" K. Nishikawa and Y. Morimoto 月刊ファインケミカル 52, 36-44 (2023).

"Divergent Synthesis of Nerolidol-Type Sesquiterpenoids Produced by Soil Bacterium from an Identical Starting Material via Diepoxide Precursors: Stereochemical Revision and Absolute Configuration of a THF Natural Product" T. Teranishi, K. Nishikawa, A. Matsuura, M. Kumagai, and Y. Morimoto Chem. Lett. 51, 1062-1066 (2022).
ABSTRACT: A divergent asymmetric synthesis of two nerolidol-type sesquiterpenoids with a five- or a six-membered ether ring was established from an identical commercially available trans,trans-farnesyl acetate through the cyclization of diepoxide precursors under simple acidic or neutral conditions, respectively. In addition, the relative configuration of a nerolidol-type sesquiterpenoid with a tetrahydrofuran ring was revised. Its absolute configuration was determined by its asymmetric synthesis and a modified Mosher’s analysis. Furthermore, the cytotoxicity and nitric oxide production inhibitory activity of the synthesized compounds were assessed.
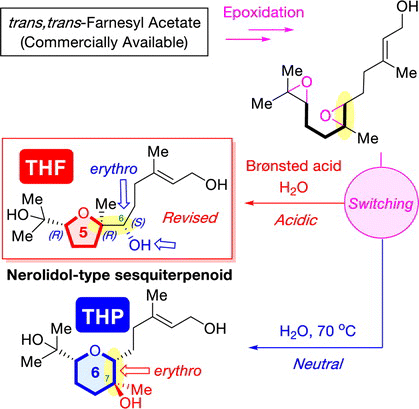
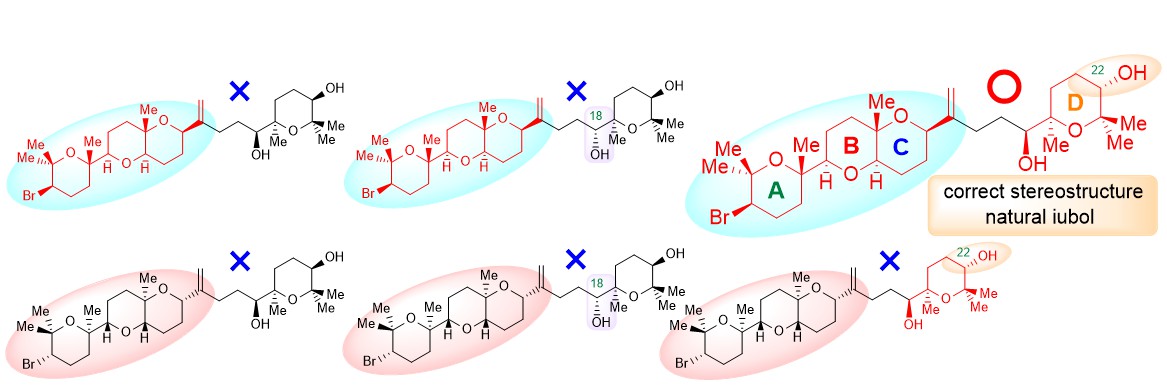
"Total Synthesis, Revised Structure, and Cytotoxic Activities of Iubol" K. Nishikawa, N. Taki, K. Nishikibe, M. Kumagai, and Y. Morimoto Chem. Lett. 51, 1000-1003 (2022).
ABSTRACT: To unambiguously establish the stereostructure of the marine cytotoxic bromotriterpenoid iubol, a member of the thyrsiferol family, asymmetric chemical synthesis has been carried out. The synthesis features a one-pot process for the tetrahydropyranyl D ring construction through a stoichiometric Sharpless asymmetric epoxidation of allylic alcohols followed by titanium chelation-assisted 6-exo oxacyclization. In this paper, we report the asymmetric total synthesis of iubol, revision of the proposed structure to the C22-epimer, and preliminary cytotoxic activities of synthetic compounds against some tumor cells.

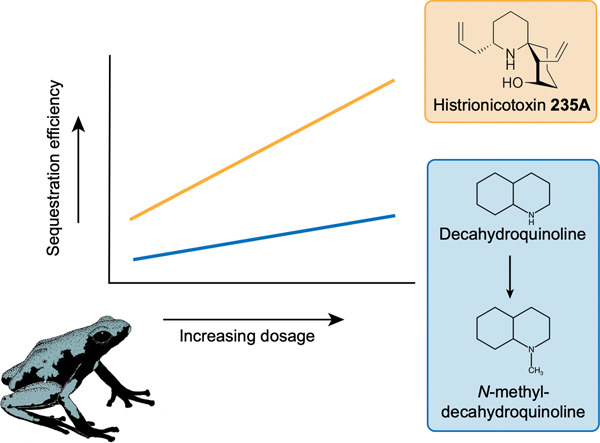
"Dose-Dependent Alkaloid Sequestration and N-Methylation of Decahydroquinoline in Poison Frogs" A. M. Jeckel, S. K. Bolton, K. R. Waters, M. M. Antoniazzi, C. Jared, K. Matsumura, K. Nishikawa, Y. Morimoto, T. Grant, and R. A. Saporito J. Exp. Zool. A Ecol. Integr. Physiol. 337, 537-546 (2022).
ABSTRCT: Sequestration of chemical defenses from dietary sources is dependent on the availability of compounds in the environment and the mechanism of sequestration. Previous experiments have shown that sequestration efficiency varies among alkaloids in poison frogs, but little is known about the underlying mechanism. The aim of this study was to quantify the extent to which alkaloid sequestration and modification are dependent on alkaloid availability and/or sequestration mechanism. To do this, we administered different doses of histrionicotoxin (HTX) 235A and decahydroquinoline (DHQ) to captive-bred Adelphobates galactonotus and measured alkaloid quantity in muscle, kidney, liver, and feces. HTX 235A and DHQ were detected in all organs, whereas only DHQ was present in trace amounts in feces. For both liver and skin, the quantity of alkaloid accumulated increased at higher doses for both alkaloids. Accumulation efficiency in the skin increased at higher doses for HTX 235A but remained constant for DHQ. In contrast, the efficiency of HTX 235A accumulation in the liver was inversely related to dose and a similar, albeit statistically nonsignificant, pattern was observed for DHQ. We identified and quantified the N-methylation of DHQ in A. galactonotus, which represents a previously unknown example of alkaloid modification in poison frogs. Our study suggests that variation in alkaloid composition among individuals and species can result from differences in sequestration efficiency related to the type and amount of alkaloids available in the environment.
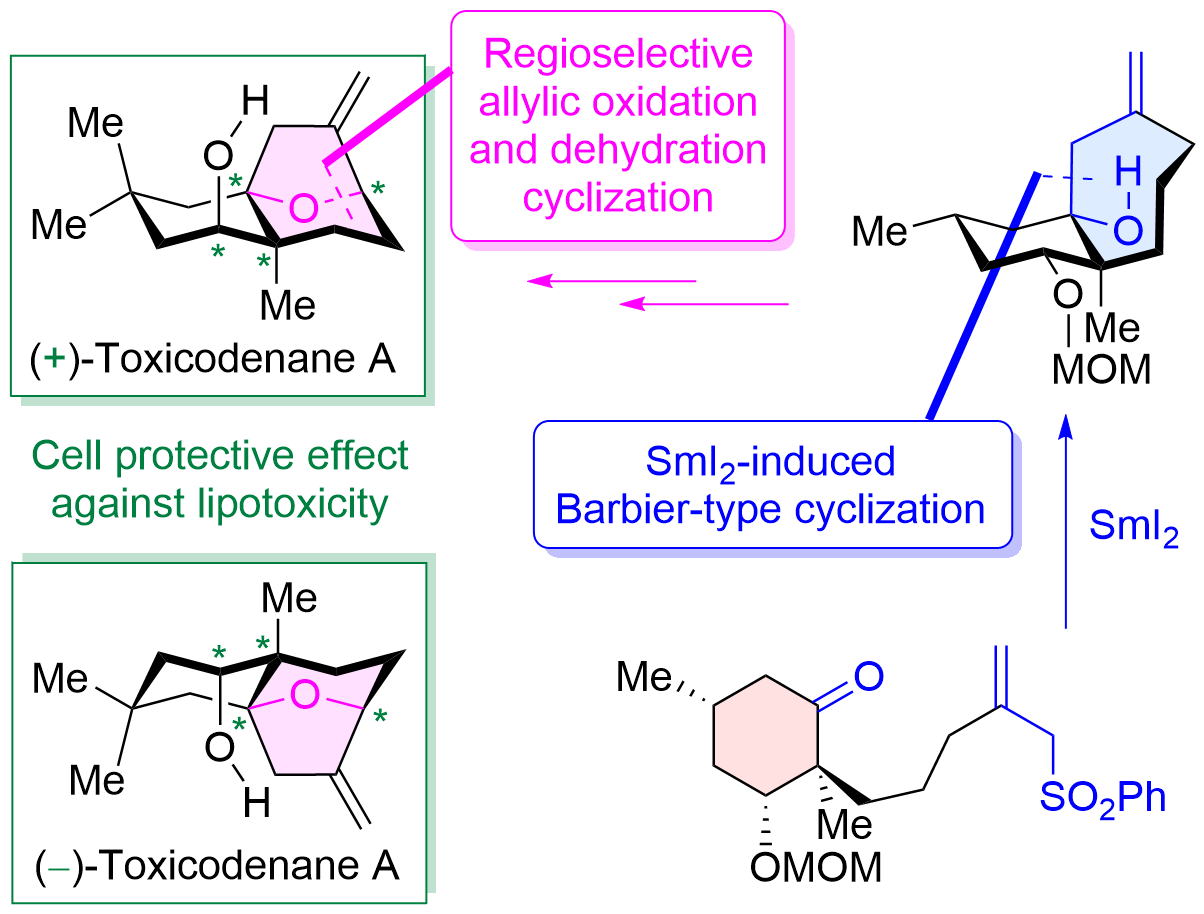
"Asymmetric Total Synthesis of Toxicodenane A by Samarium-Iodide-Induced Barbier-Type Cyclization and Its Cell-Protective Effect against Lipotoxicity" K. Nishikawa, K. Kikuta, T. Tsuruta, H. Nakatsukasa, S. Sugahara, S. Kume, and Y. Morimoto Org. Lett. 24, 531-535 (2022).
Selected as Supplementary Cover Art.
Highlighted in Synfacts 18, 0441 (2022)
ABSTRACT: The asymmetric total synthesis of toxicodenane A, a sesquiterpenoid expected to be promising for diabetic nephropathy, was achieved. In the synthesis, a samarium iodide (SmI2)-induced Barbier-type cyclization and a regio- and stereoselective allylic oxidation followed by a dehydration cyclization were employed as key steps. Furthermore, the first asymmetric syntheses of both enantiomers were accomplished using the previously mentioned synthetic strategy. Finally, the synthetic compounds significantly inhibited lipotoxicity-mediated inflammatory and fibrotic responses in mouse renal proximal tubular cells.

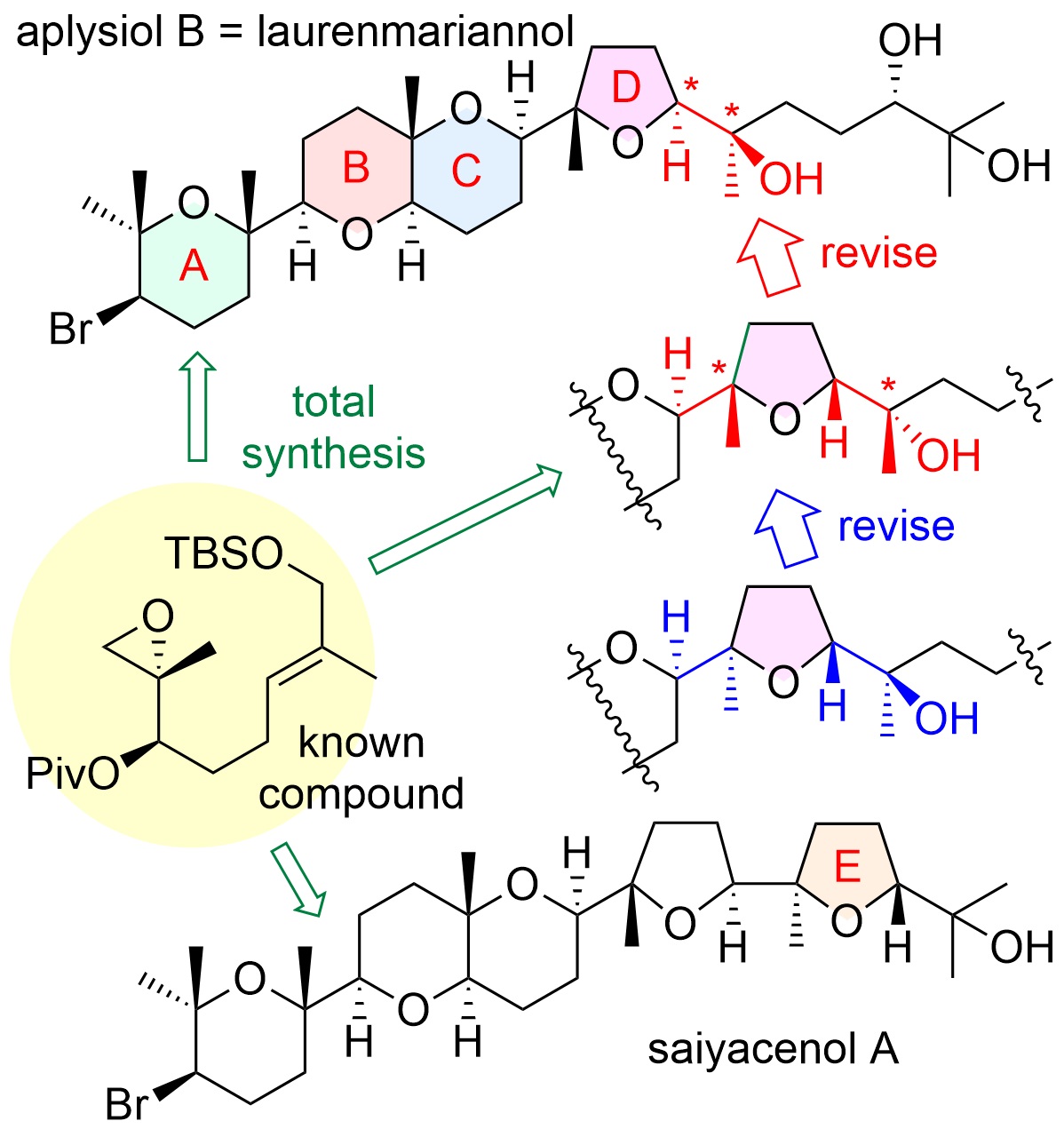
"Asymmetric Total Syntheses, Stereostructures, and Cytotoxicities
of Marine Bromotriterpenoids Aplysiol B (Laurenmariannol) and Saiyacenol
A" K. Nishikibe, K. Nishikawa, M. Kumagai, M. Doe, and Y. Morimoto
Chem. Asian J. 17, e202101137 (2022) [ Open Access ].
Selected as Front Cover.
ABSTRACT: Total assignments of stereostructures of marine cytotoxic bromotriterpenoids,
aplysiol B (laurenmariannol) and saiyacenol A, were accomplished through
their asymmetric chemical syntheses to elucidate their ambiguous stereostructures
and whether or not other members showing the opposite chirality for the
ABC ring system exist. Moreover, their preliminary growth inhibitory activities
against some tumor cells were also evaluated.

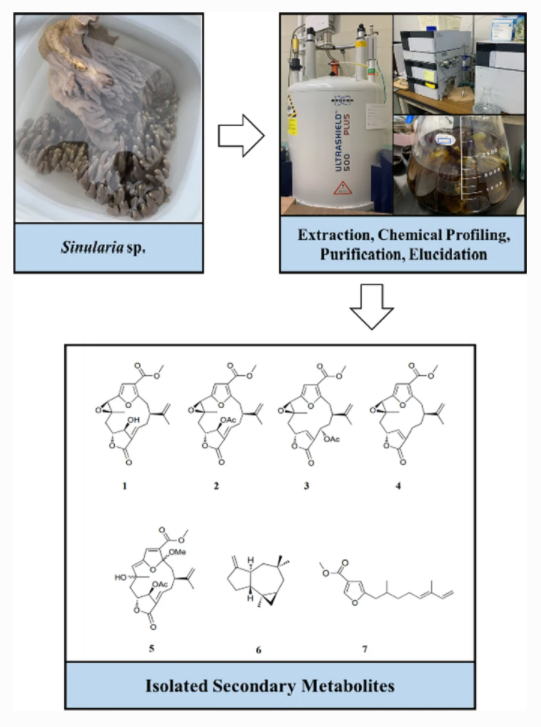
"Furanocembranoid from the Okinawan Soft Coral Sinularia sp." M. Nagasaka, K. Tani, K. Nishikawa, R. Kinjo, and T. Ishii Nat. Prod. Bioprospect. 12, Article number 7 (2022) [ Open Access ].
ABSTRACT: One new furanocembranoid diterpene, 11-hydroxy-Δ12(13)-pukalide (1), along with six known secondary metabolites, 11-acetoxy-Δ12(13)-pukalide (2), 13α-acetoxypukalide (3), pukalide (4), 3α-methoxyfuranocembranoid (5), Δ9(15)-africanene (6), and methyl (5′E)-5-(2′,6′-dimethylocta-5′,7′-dienyl)furan-3-carboxylate (7) were isolated from the Okinawan soft coral Sinularia sp. Their chemical
structures were elucidated based on spectroscopic analysis (FTIR, NMR,
and HRESIMS), and the relative stereochemistry of 1 was determined by NOESY experiments and acetylation, which yielded derivative
2. In addition, compounds 1 and 7 exhibited toxicity in the brine shrimp lethality test.
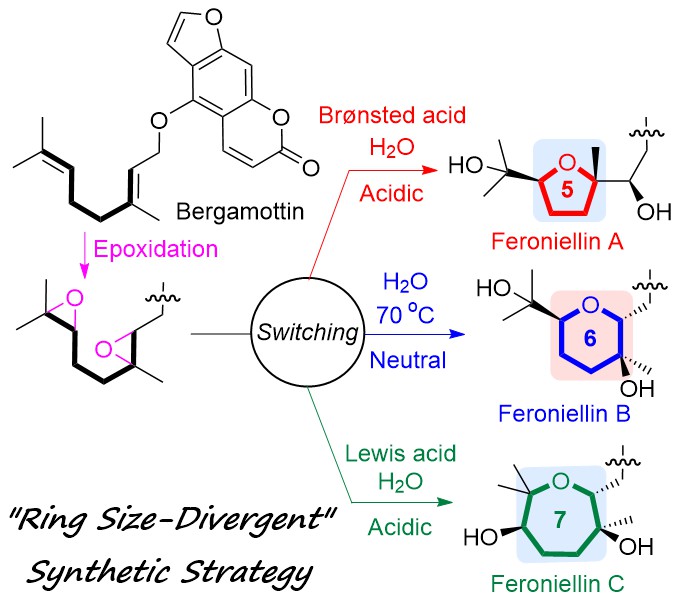
"Establishing a “Ring Size-Divergent” Synthetic Strategy: Synthesis,
Structural Revision, and Absolute Configuration of Feroniellins" K.
Nishikawa, T. Niwa, K. Nishikibe, M. Kumagai, and Y. Morimoto Chem. Eur. J. 27, 11045–11049 (2021).
ABSTRACT: A “ring-size-divergent” strategy enabled us to divergently synthesize
the five-, six-, and seven-membered ether rings of feroniellin analogs
from diepoxides under simple acidic or neutral conditions in only two steps
from bergamottin. Additionally, the proposed structures of feroniellins
A and B were revised, and the absolute configurations of all feroniellins
were determined from their asymmetric synthesis.
"One‐Step Synthesis of the 1‐Azaspiro[5.5]undecane Skeleton Characteristic
of Histrionicotoxin Alkaloids from Linear Substrates via Hg(OTf)2‐Catalyzed Cycloisomerization" K. Matsumura, K. Nishikawa, H. Yoshida,
T. Niwa, Y. Fushii, M. Doe, and Y. Morimoto Chem. Asian J. 16, 1882–1886 (2021).
ABSTRACT: A one-step synthesis of the 1-azaspiro[5.5]undecane skeleton in histrionicotoxin
alkaloids from a linear substrate was realized utilizing a Hg(OTf)2-catalyzed cycloisomerization reaction. Histrionicotoxin alkaloids as potential
target drugs were successfully synthesized via our developed cyclization.
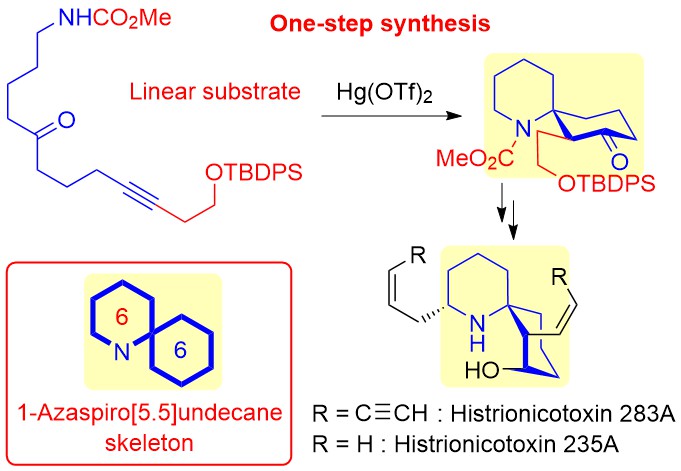
"Tetrodotoxin Framework Construction from Linear Substrates Utilizing
a Hg(OTf)2-Catalyzed Cycloisomerization Reaction: Synthesis of the Unnatural Analogue 11-nor-6,7,8-Trideoxytetrodotoxin" K. Nishikawa, T. Noguchi, S. Kikuchi, T. Maruyama, Y. Araki, M. Yotsu-Yamashita, and Y. Morimoto Org. Lett. 23, 1703–1708 (2021).
ABSTRACT: In this contribution, we propose a new synthetic approach to tetrodotoxin
(TTX), one of the most famous marine toxins that, after first preparing
a functionalized linear substrate, forms a cyclohexane core from the substrate
utilizing our mercuric triflate (Hg(OTf)2)-catalyzed cycloisomerization reaction. The concept was applied to the synthesis of 11-nor-6,7,8-trideoxyTTX and 11-nor-4,9-anhydro-6,7,8-trideoxyTTX, which are unnatural TTX analogues, demonstrating
the validity of our new approach.
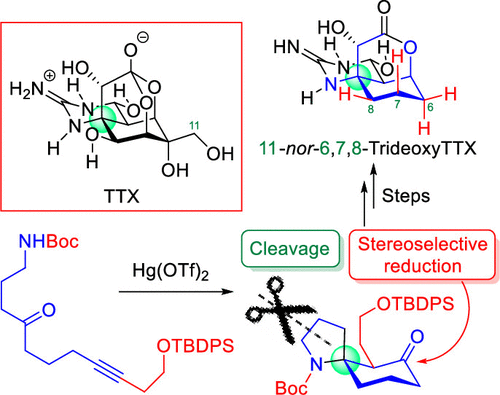
"Natural Product Synthesis Strategy Based on the Concept of Directly
Constructing the Ring Skeletons from Linear Substrates" K. Nishikawa,
M. Kumagai, K. Matsumura, K. Nishikibe, and Y. Morimoto J. Synth. Org. Chem., Jpn. 79, 197-209 (2021).
ABSTRACT: Our concept of natural product synthesis is to directly construct the
ring skeletons, frequently occurring in natural products with strong biological
activities, from easily accessible linear substrates, and our group has
established practical methods for synthesizing useful natural products
along our synthetic strategy. First, we developed a cycloisomerization
reaction to directly synthesize nitrogen-containing spirocycles from linear
substrates, accompanied with construction of a stereogenic tetrasubstituted
spiro-carbon. The reaction enabled us to achieve the efficient total synthesis
of lepadiformines, revealing a phenomenon of their enantiodivergence. The
synthesis of histrionicotoxins, frog poisons, was also accomplished through
our original cyclization reaction. In addition, we found the critical switching
of cyclization modes of polyepoxides in acidic aqueous media and neutral
water, and the novel cascade cyclization was applied to the synthesis of
natural products.
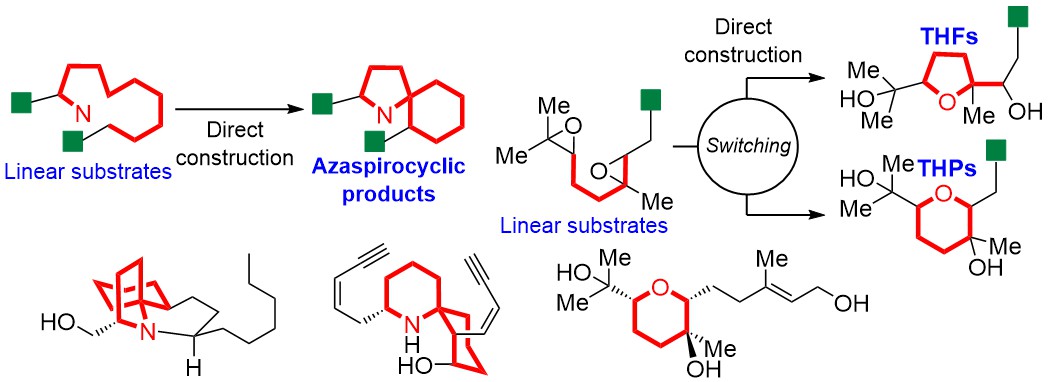
"4β-Hydroxywithanolide E and Withanolide E from Physalis peruviana L. Inhibit Adipocyte Differentiation of 3T3-L1 Cells through Modulation
of Mitotic Clonal Expansion" M. Kumagai, I. Yoshida, T. Mishima, M.
Ide, K. Fujita, M. Doe, K. Nishikawa, and Y. Morimoto J. Nat. Med. 75, 232–239 (2021).
ABSTRACT: Obesity is a risk factor for many diseases, including type 2 diabetes and cardiovascular disease, and is related to the rising morbidity and mortality. Discovery of agents targeting adipogenesis, especially from natural sources, is important for the treatment of obesity. Here, we aimed to identify anti-adipogenic substances in methanol extracts of Physalis peruviana and to investigate their effect, along with underlying mechanisms. Activity-guided
fractionation of the extract revealed 4β-hydroxywithanolide E (HWE) and
withanolide E (WE) as the adipogenesis inhibitors. Both compounds suppressed
mRNA expression of central adipogenic transcription factors, peroxisome
proliferator-activated receptor γ, and CCAAT/enhancer-binding protein α
in the early stage of adipocyte differentiation. The inhibitory action
of these two withanolides on adipogenesis was largely limited to this stage.
The proliferation of preadipocytes was markedly suppressed by treatment
with HWE and WE for 24 and 48 h in the differentiation medium, and cell-cycle
arrest in the G0/G1 phase was observed. Therefore, our results suggested
that withanolides from P. peruviana to be novel anti-adipogenic compounds that modulate mitotic clonal expansion.
”Use of Whole‐Body Cryosectioning and Desorption Electrospray Ionization
Mass Spectrometry Imaging to Visualize Alkaloid Distribution in Poison
Frogs" A. M. Jeckel, K. Matsumura, K. Nishikawa, Y. Morimoto, R. A.
Saporito, T. Grant, and D. R. Ifa J. Mass Spectrom. 55, e4520 (2020).
ABSTRACT: Ambient mass spectrometry is useful for analyzing compounds that would
be affected by other chemical procedures. Poison frogs are known to sequester
alkaloids from their diet, but the sequestration pathway is unknown. Here,
we describe methods for whole-body cryosectioning of frogs and use desorption
electrospray ionization mass spectrometry imaging (DESI-MSI) to map the
orally administered alkaloid histrionicotoxin 235A in a whole-body section
of the poison frog Dendrobates tinctorius. Our results show that whole-body
cryosectioning coupled with histochemical staining and DESI-MSI is an effective
technique to visualize alkaloid distribution and help elucidate the mechanisms
involved in alkaloid sequestration in poison frogs.
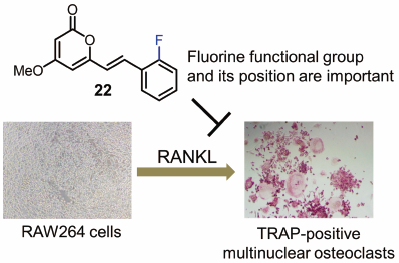
"Fluorinated Kavalactone Inhibited RANKL-Induced Osteoclast Differentiation
of RAW264 Cells" M. Kumagai, K. Nishikawa, T. Mishima, I. Yoshida,
M. Ide, A. Watanabe, K. Fujita, and Y. Morimoto Biol. Pharm. Bull. 43, 898–903 (2020) [ Open Access ].
ABSTRACT: Bone loss and bone-related disease are associated with the deregulation
of osteoclast function, and therefore agents that affect osteoclastogenesis
have attracted attention. The purpose of the present study was to discover
modified kavalactone analogs as potential anti-osteoclastogenic agents.
We assessed the effect of 26 analogs on osteoclast differentiation in vitro. The most potent compound, (E)-6-(2-fluorostyryl)-4-methoxy-2H-pyran-2-one (22), suppressed receptor activator of nuclear factor-κB ligand (RANKL)-induced
osteoclastogenic differentiation of RAW264 cells with IC50 values of 4.3 µM. A partial structure–activity relationship study revealed
the importance of fluorine and its position within the 5,6-dehydrokawain
skeleton. The results of a pit formation assay suggested that compound
22 prevents osteoclastic bone resorption by inhibiting osteoclastogenesis. Moreover, compound 22 downregulated mRNA expression levels of RANKL-induced nuclear factor of
activated T cells c1 (NFATc1) and osteoclastogenesis-related genes. These
results suggest that (E)-6-(2-fluorostyryl)-4-methoxy-2H-pyran-2-one scaffold could lead to the identification of new anti-resorptive
agents.
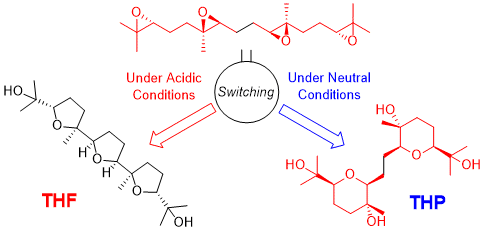
"Critical Switching of Cyclization Modes of Polyepoxides in Acidic
Aqueous Media and Neutral Water: Synthesis and Revised Structure of a Nerolidol‐Type
Sesquiterpenoid" K. Nishikawa, K. Morita, S. Hashimoto, A. Hoshino,
T. Ikeuchi, M. Kumagai, and Y. Morimoto Angew. Chem. Int. Ed. 58, 10168–10172 (2019);
Angew. Chem. 131, 10274–10278 (2019).
Selected as Front Cover.
ABSTRACT: Biomimetic epoxide-opening cascades of polyepoxides enable the efficient
and rapid construction of polyether frameworks. Herein, we show that the
epoxide-opening cascade cyclization that affords tetrahydrofuran products
in acidic aqueous media produces tetrahydropyran (THP) in neutral water.
THP formation proceeded by simply heating polyepoxides in neutral water
and followed a different cyclization mode from those observed so far. The
novel cascade cyclization in H2O was applied to the synthesis of a new nerolidol-type sesquiterpenoid,
resulting in revision of the proposed structure and determination of the
absolute configuration.

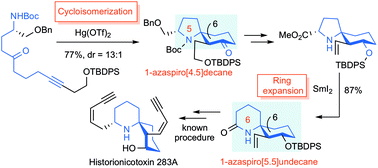
“Formal Total Synthesis of Histrionicotoxin Alkaloids via Hg(OTf)2-catalyzed Cycloisomerization and SmI2-induced Ring Expansion” K. Matsumura, K. Nishikawa, H. Yoshida, M. Doe,
and Y. Morimoto RSC Adv. 8, 11296-11303 (2018) [ Open Access ].
ABSTRACT: The efficient formal total synthesis of histrionicotoxin alkaloids was
achieved. In this process, two key reactions were used to construct a core
1-azaspiro[5.5]undecane framework common to histrionicotoxins: a mercuric
triflate (Hg(OTf)2)-catalyzed cycloisomerization of a linear substrate, which was developed
in our laboratory, and a samarium iodide (SmI2)-mediated ring expansion.
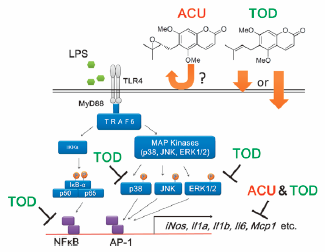
"Evaluation of Aculeatin and Toddaculin Isolated from Toddalia asiatica as Anti-inflammatory Agents in LPS-Stimulated RAW264 Macrophages"
M. Kumagai, A. Watanabe, I. Yoshida, T. Mishima, M. Nakamura, K. Nishikawa,
and Y. Morimoto Biol. Pharm. Bull. 41, 132-137 (2018) [ Open Access ].
ABSTRCT: Anti-inflammatory activity of aculeatin and toddaculin, which are coumarins
with a similar structure isolated from Toddalia asiatica (L.) LAM., was evaluated using lipopolysaccharide (LPS)-stimulated RAW264 mouse macrophage cells. Both aculeatin and toddaculin significantly inhibited mRNA expression of inflammatory mediators and nitric oxide production. Furthermore, Toddaculin suppressed LPS-induced phosphorylation of p38 and extracellular signal-regulated kinase (ERK)1/2 and inhibited LPS-induced activation of nuclear factor-kappaB (NF-κB). However, aculeatin did not exhibit such effects, suggesting that aculeatin and toddaculin suppress LPS-induced inflammation of RAW264 cells via different mechanisms. The cellular uptake of these compounds was also evaluated. Toddaculin was detected in RAW264 cells after 4 and 24 h. However, aculeatin levels were not observed in RAW264 cells at all incubation intervals. These results indicate that de-epoxidation of a prenyl group can increase hydrophobicity of molecule and is thought to accelerate cellular uptake and/or interactions with the phospholipid bilayers of cell membranes.
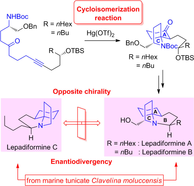
"Total Syntheses of Lepadiformine Marine Alkaloids with Enantiodivergency,
Utilizing Hg(OTf)₂-Catalyzed Cycloisomerization Reaction and Their Cytotoxic
Activities" K. Nishikawa, K. Yamauchi, S. Kikuchi, S. Ezaki, T. Koyama, H. Nokubo, K. Matsumura, T. Kodama, M. Kumagai, and Y. Morimoto Chem. Eur. J. 23, 9535-9545 (2017).
Selected as Back Cover.
ABSTRACT: A phenomenon of enantiodivergence was found in lepadiformine alkaloids isolated from a single species marine tunicate Clavelina moluccensis through their syntheses. The enantioselective total syntheses have been achieved by a key mercury(II) triflate-catalyzed cycloisomerization reaction developed in our laboratory (see scheme), and cytotoxic activities of synthesized compounds were also evaluated.

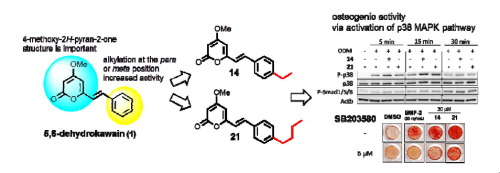
"Synthesis of Novel 5,6-Dehydrokawain Analogs as Osteogenic Inducers and Their Action Mechanisms" M. Kumagaia, K. Nishikawa, T. Mishima, I. Yoshida, M. Ide, K. Koizumi, M. Nakamura, and Y. Morimoto Bioorg. Med. Chem. Lett. 27, 2401–2406 (2017).
ABSTRACT: An imbalance between bone resorption by osteoclasts and bone formation
by osteoblasts can cause bone loss and bone-related disease. In a previous
search for natural products that increase osteogenic activity, we found
that 5,6-dehydrokawain (1) from Alpinia zerumbet promotes osteoblastogenesis. In this study, we synthesized and evaluated
series of 5,6-dehydrokawain analogs. Our structure-activity relationships
revealed that alkylation of para or meta position of aromatic ring of 1
promote osteogenic activity. Among the potential analogs we synthesized,
(E)-6-(4-Ethylstyryl)-4-methoxy-2H-pyran-2-one (14) and (E)-6-(4-Butylstyryl)-4-methoxy-2H-pyran-2-one (21) both significantly up-regulated Runx2 and Osterix mRNA expression at
10 µM. These osteogenic activities could be mediated by bone morphogenetic
protein (BMP) and activation of p38 MAPK signaling pathways. Compounds
14 and 21 also inhibited RANKL-induced osteoclast differentiation of RAW264 cells.
These results indicated that novel 5,6-dehydrokawain analogs not only increase
osteogenic activity but also inhibit osteoclast differentiation, and could
be potential lead compounds for the development of anti-osteoporosis agents.
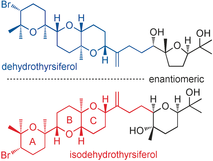
"Total Synthesis of the Cytotoxic Marine Triterpenoid Isodehydrothyrsiferol
Reveals Partial Enantiodivergency in the Thyrsiferol Family of Natural
Products" A. Hoshino, H. Nakai, M. Morino, K. Nishikawa, T. Kodama,
K. Nishikibe, and Y. Morimoto Angew. Chem. Int. Ed. 56, 3064-3068 (2017);
Angew. Chem. 129, 3110–3114 (2017).
ABSTRACT: Enantioselective total synthesis of the cytotoxic marine triterpenoid
isodehydrothyrsiferol revealed partial enantiodivergence in that the ABC
ring system is enantiomeric to that of the other members of this natural
product family. Furthermore, this unprecedented partial enantiodivergence
is observed between dehydrothyrsiferol and isodehydrothyrsiferol, which
originate from a single species, the red alga Laurencia viridis.
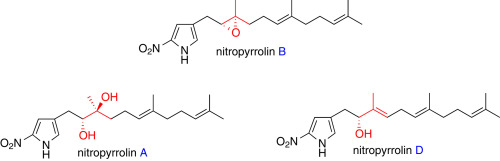
"Total Synthesis of Nitropyrrolins A, B, and D" H. Mitani, T.
Matsuo, T. Kodama, K. Nishikawa, Y. Tachi, and Y. Morimoto Tetrahedron 72, 7179–7184 (2016).
ABSTRACT: The chemical synthetic method of cytotoxic nitropyrrolins A (1), B (2), and D (4), 2-nitropyrrole terpenoids rarely occurring in nature, has been developed
for further biological studies. After the synthesis of nitropyrrolin B
has first been achieved, nitropyrrolin B was transformed into nitropyrrolins
A and D in two steps and one step, respectively. The regio- and stereoselective
epoxide-cleavage reaction was highlighted in the direct conversion of nitropyrrolin
B to D.
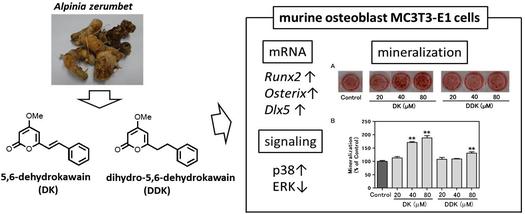
"5,6-Dehydrokawain from Alpinia zerumbet Promotes Osteoblastic MC3T3-E1 Cell Differentiation" M. Kumagai, T. Mishima, A. Watanabe, T. Harada, I. Yoshida, K. Fujita,
M. Watai, S. Tawata, K. Nishikawa, and Y. Morimoto Biosci. Biotech. Biochem. 80, 1425-1432 (2016) [ Open Access ].
ABSTRACT: Bone homeostasis is maintained by balancing bone formation and bone resorption, but an imbalance between them is associated with various bone-related diseases such as osteoporosis and rheumatoid arthritis. We found that 5,6-dehydrokawain (DK) and dihydro-5,6-dehydrokawain (DDK), which were isolated aspromising compounds from Alpinia zerumbet rhizomes, promote differentiation of osteoblastic MC3T3-E1 cells. DK and DDK increased the alkaline phosphatase activity and matrix mineralization of MC3T3-E1 cells. DK exerts larger effects than DDK. The gene expression of runt-related transcription factor 2 and osterix, which are essential transcription factors in the early period of osteoblast differentiation, was significantly increased by DK treatment. The mRNA level of distal-less homeobox 5 was also enhanced by DK treatment, and DK activated the p38 mitogen-activated protein kinase pathway. Therefore, DK may have clinical potential for preventing osteoporosis, and could be considered as a potential anabolic therapeutic agent. 5,6-Dehydrokawain (DK) and dihydro-5,6-dehydrokawain (DDK) from Alpinia zerumbet rhizomes, promote differentiation of osteoblastic MC3T3-E1 cells.
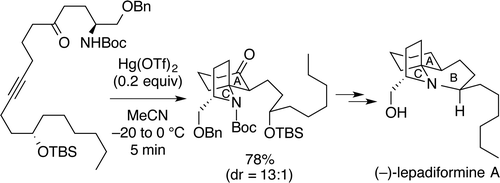
"Total Synthesis of (−)-Lepadiformine A Utilizing Hg(OTf)2-Catalyzed Cycloisomerization Reaction" K. Nishikawa, S. Kikuchi,
S. Ezaki, T. Koyama, H. Nokubo, T. Kodama, Y. Tachi, and Y. Morimoto Org. Lett. 17, 5772-5775 (2015);
Highlighted in Synfacts 2, 116 (2016).
ABSTRACT: A cytotoxic marine alkaloid (−)-lepadiformine A (1) possesses a unique structure characterized by the trans-1-azadecalin AB ring system fused with the AC spiro-cyclic ring. In this research, we found that a cycloisomerization reaction from amino ynone 2 to a 1-azaspiro[4.5]decane skeleton 3, corresponding to the AC ring system of 1, is promoted by Hg(OTf)2. Thus, we have accomplished the efficient total synthesis of (−)-lepadiformine
A in 28% overall yield by featuring the novel Hg(OTf)2-catalyzed cycloisomerization.
"Total Synthesis and Complete Stereochemical Assignment of Heronapyrroles
A and B" T. Matsuo, S. Hashimoto, K. Nishikawa, T. Kodama, S. Kikuchi,
Y. Tachi, Y. Morimoto Tetrahedron Lett. 56, 5345-5348 (2015).
ABSTRCT: Heronapyrroles A and B with promising and selective antibacterial activity
but no cytotoxicity against mammalian cell lines are among members of rare
and unique 4-farnesylated-2-nitropyrrole natural products. The absolute
configurations at C7 and C15 have been proposed to be 7S and 15R by the modified Mosher method. In this Letter, we have achieved the total synthesis of natural (+)-heronapyrroles A (1) and B (2) and report that the correct absolute configurations are 7R, 8S, and 15S as shown in the structural formulas 1 and 2.

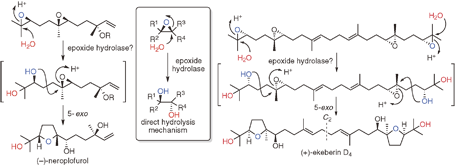
"Biomimetic Total Synthesis of (-)-Neroplofurol and (+)-Ekeberin D4
Triggered by Hydrolysis of Terminal Epoxides" T. Kodama, S. Aoki,
T. Matsuo, Y. Tachi, K. Nishikawa, and Y. Morimoto Chem. Lett. 43, 1662-1664 (2014).
ABSTRACT: To accumulate the chemical basis of epoxide-opening cascade biogenesis,
chemical syntheses of sesqui- and triterpenoids were performed. The biomimetic
total syntheses of (−)-neroplofurol (1) and (+)-ekeberin D4 (2) were accomplished by protic acid-catalyzed hydrolysis of the terminal
epoxide from nerolidol diepoxide 3 and squalene tetraepoxide 4 through single and double 5-exo cyclizations in intermediates 5 and 6, respectively. This chemical reaction mimics the direct hydrolysis mechanism of epoxide hydrolases, enzymes that catalyze an epoxide-opening reaction to finally produce vicinal diols.
"Analysis of Enantiofacial Selective Epoxidation Catalyzed by Flavin-Containing
Monooxygenase Lsd18 Involved in Ionophore Polyether Lasalocid Biosynthesis"
G. Suzuki, A. Minami, M. Shimaya, T. Kodama, Y. Morimoto, H. Oguri, and
H. Oikawa Chem. Lett. 43, 1779-1781 (2014).
ABSTRACT: Enzymatic epoxidation represents a key biosynthetic transformation in the construction of polyether skeletons. A single flavin-containing monooxygenase, Lsd18, is involved in ionophore polyether lasalocid biosynthesis and participates in the enantioselective epoxidations of the diene precursor. Biotransformation studies utilizing structurally simplified monoolefin analogs with different substitution patterns revealed important structural requirements for the enantiofacial selectivity of Lsd18-catalyzed epoxidations. These results enabled us to propose a substrate binding model of Lsd18, which was applied to the biosynthesis of other polyethers.

"A Convergent Total Synthesis of Antiplasmodial C2 Symmetric (+)-Ekeberin D4" T. Kodama, S. Aoki, S. Kikuchi, T. Matsuo, Y. Tachi, K. Nishikawa,
and Y. Morimoto Tetrahedron Lett. 54, 5647-5649 (2013).
ABSTRACT: The first concise total synthesis of C2 symmetric (+)-ekeberin D4 (1) that exhibits antiplasmodial activity has been achieved in total nine steps and 27% yield from the known diol 4. The efficient synthetic method features the regio- and diastereoselective
epoxidation of 4 and convergent coupling between half fragments 2 and 3 by taking into account the C2 symmetric property.

"Biomimetic Epoxide-Opening Cascades of Oxasqualenoids Triggered by
Hydrolysis of the Terminal Epoxide" Y. Morimoto, E. Takeuchi, H. Kambara,
T. Kodama, Y. Tachi, and K. Nishikawa Org. Lett. 15, 2966–2969 (2013).
ABSTRACT: The biomimetic epoxide-opening cascades from squalene polyepoxides 4–6 to triterpene polyethers (oxasqualenoids) teurilene (1), glabrescol (2), and omaezakianol (3), respectively, were reproduced in a single event by chemical reaction.
These cascades proceeded through the 5-exo tandem cyclization triggered by Brønsted acid-catalyzed hydrolysis of
the terminal epoxide, mimicking the direct hydrolysis mechanism of epoxide
hydrolases.

"TIPSOTf-promoted Tandem Reaction through Rearrangement of Epoxides
into Aldehydes with Selective Alkyl Migration Followed by Prins-Type Cyclization
to Cyclopentanes" T. Kodama, S. Harada, T. Tanaka, Y. Tachi, and Y.
Morimoto Synlett 3, 458-462 (2012)
ABSTRACT: The tandem reaction of trisubstituted epoxides to cyclopentanes promoted
by TIPSOTf in nitromethane has been found. It consists of stereospecific
rearrangement of epoxides into aldehydes accompanied with selective alkyl
migration and subsequent Prins-type cyclization of the aldehydes generated
to cyclopentanes.

"Total Synthesis of Marine Halogen-Containing Triterpene Polyethers
Using Regioselective 5-exo and 6-endo Cyclizations and the Stereochemistry" Y. Morimoto J. Synth. Org. Chem., Jpn. 70, 154-165 (2012).
ABSTRACT: Aurilol (1), intricatetraol (3), and enshuol (5), marine halogen-containing members of a family of squalene-derived triterpene
polyethers named oxasqualenoids, were isolated from the sea hare Dolabella auricularia, the red alga Laurencia inricata, and omaezakiana Masuda, respectively. Although their planar structures and partial configurations
were elucidated by spectroscopic and chemical analyses, until now their
entire configurations had not been determined. Many other types of oxasqualenoids
have also been isolated from both marine and terrestrial organisms; however,
it is often difficult to determine their stereostructures even by modern
highly advanced spectroscopic methods, especially in the case of acyclic
systems that include stereogenic quaternary carbon centers. Such systems
expose the technical limitations of the current highly advanced NMR spectroscopic
methods used for the structural elucidation of diverse and complex natural
products. Herein, we report the total assignments of the previously incomplete
stereostructures of 1, 3, and 5 to 2, 4, and 6, respectively, through the first asymmetric total syntheses featuring
regioselective 5-exo and 6-endo cyclizations of bishomoepoxy alcohols.
“Diastereoselective Synthesis of the Indeno-tetrahydropyridine Core Bearing
a Diaryl-substituted Stereogenic Quaternary Carbon Center of Haouamine
B” T. Tanaka, H. Inui, H. Kida, T. Kodama, T. Okamoto, A. Takeshima, Y.
Tachi and Y. Morimoto Chem. Commun. 47, 2949-2951 (2011).
ABSTRACT: The characteristic indeno-tetrahydropyridine core of cytotoxic haouamine B (2) was efficiently synthesized featuring the diastereoselective construction
of a diaryl-substituted stereogenic quaternary center by an intramolecular
Pd-catalyzed α-C-arylation and subsequent direct conversion of the vinylogous
imide function into the C2–C25 double bond by TsNHNH2.
"Rings D-seco and B,D-seco Tetranortriterpenoids from Root Bark of
Entandrophragma Angolense" T. K. Nsiama, H. Okamura, T. Hamada, Y. Morimoto, M. Doe, T. Iwagawa,
and M. Nakatani Phytochemistry 72, 1854-1858 (2011).
“Cytotoxic Isomalabaricane Derivatives and a Monocyclic Triterpene Glycoside
from the Sponge Rhabdastrella Globostellata” M. Hirashima, K.Tsuda, T. Hamada, H. Okamura, T. Furukawa, S. Akiyama,
Y. Tajitsu, R. Ikeda, M. Komatsu, M. Doe, Y. Morimoto, M. Shiro, R. W.
M. van Soest, K. Takemura, and T. Iwagawa J. Nat. Prod. 73, 1512-1518 (2010).
“Cytotoxic Biscembranes from the Soft Coral Saricophyton glaucum” T. Iwagawa, K. Hashimoto, Y. Yokogawa, H. Okamura, M. Nakatani, M. Doe,
Y. Morimoto and K. Takemura J. Nat. Prod. 72, 946-949 (2009).
“Total Synthesis and Determination of the Absolute Configuration of (+)-Omaezakianol
” Y. Morimoto, T. Okita and H. Kambara Angew. Chem., Int. Ed. 48, 2538-2541 (2009).
Angew. Chem. 121, 2576-2579 (2009).
ABSTRACT: The first asymmetric total synthesis of the marine tetracyclic oxasqualenoid (+)-omaezakianol features a convergent olefin cross-metathesis between a monotetrahydrofuran fragment and a triepoxy alkene, and cascade oxacyclizations of a triepoxy alcohol to form the right-hand three ether rings. The total synthesis proved the absolute configuration of (+)-omaezakianol to be that shown.

“Squalene-Derived Triterpene Polyethers from the Red Alga Laurencia Omaezakiana” Y. Matsuo, M. Suzuki, M. Masuda, T. Iwai and Y. Morimoto Helv. Chim. Acta 91, 1261-1266 (2008).
ABSTRACT: In our continuing search on halogenated metabolites from species of the
red algal genus Laurencia, a novel squalene-derived triterpene polyether, named omaezakianol (2), was isolated from Laurencia omaezakiana Masuda along with 15,16-anhydrothyrsiferol (3). Their structures were determined by spectral and chemical methods.
“Limonoids from the Stem Bark of Cedrela Odorata” N. T. Kipassa, T. Iwagawa, H. Okamura, M. Doe, Y. Morimoto, and M. Nakatani
Photochemistry 69, 1782-1787 (2008).
“The Role of Chemical Synthesis in Structure Elucidation of Oxasqualenoids”
Y. Morimoto Org. Biomol. Chem. 6, 1709-1719 (2008).
ABSTRACT: Recently, highly oxidized and structurally diverse triterpene polyethers,
which are thought to be biogenetically squalene-derived natural products
(oxasqualenoids), have been isolated from both marine and terrestrial organisms.
However, it is often difficult to determine their stereostructures even
by the current, highly advanced spectroscopic methods, especially in acyclic
systems including stereogenic quaternary carbon centers. In such cases,
it is effective to predict and synthesize the possible stereostructures.
Herein, we report total assignments of the previously incomplete stereostructures
of an epoxy tri-THF diol, intricatetraol and enshuol, members of the oxasqualenoids,
through the first asymmetric total syntheses of the natural products, the
configurations of which are difficult to determine by other means. Since
this article is basically written as a communication without detailed experimental
procedures and spectroscopic data, original papers with full data should
follow.
.gif)
“Three Mexicanolides from the Root Bark of Entandrophragma Angolense” T. N. Kipassa, H. Okamura, M. Doe, Y. Morimoto, T. Iwagawa, and M. Nakatani
Heterocycles 75, 157-164 (2008).
“Assignment of the Absolute Configuration of the Marine Pentacyclic Polyether
(+)-Enshuol by Total Synthesis” Y. Morimoto, H. Yata, and Y. Nishikawa
Angew. Chem., Int. Ed. 46, 6481-6484 (2007);
Angew. Chem. 119, 6601-6604 (2007).
ABSTRACT: The complete stereostructure of the marine pentacyclic triterpene polyether
(+)-enshuol is shown. Asymmetric total synthesis confirmed the configuration
predicted on the basis of NMR spectroscopic data of the previously synthesized
natural products aurilol and glabrescol, substructures of which are present
in enshuol, and disproved an earlier prediction based on biogenetic considerations.
.gif)
“Total Synthesis and Determination of the Absolute Configuration of (+)-Intricatetraol” Y. Morimoto, T. Okita, M. Takaishi, and T. Tanaka Angew. Chem., Int. Ed. 46, 1132-1135 (2007);
Angew. Chem. 119, 1150-1153 (2007).
ABSTRACT: The total synthesis of the marine triterpene polyether (+)-intricatetraol (1) has revealed its absolute configuration, which could not be determined
even by spectroscopic methods. The approach features the enantioselective
construction of the unique vicinal bromochloro functionality and an efficient
olefin-metathesis strategy that takes the C2 symmetry of the target into consideration.
.gif)
“Two-directional Synthesis and Stereochemical Assignment toward a C-2 Symmetric
Oxasqualenoid (+)-Intricatetraol ” Y. Morimoto, M. Takaishi, N. Adachi,
T. Okita, and H.Yata Org. Biomol. Chem. 4, 3220-3222 (2006).
ABSTRACT: The asymmetric synthesis of tetraol (+)-3, a degradation product derived from a C2 symmetric oxasqualenoid intricatetraol 1, has been achieved through the two-directional synthesis starting from diol 7, realizing the further additional assignment of the incomplete stereostructure
of 1, the stereochemistry of which is difficult to determine otherwise.
.gif)
“Reagent-Controlled Swiching of 5-exo to 6-endo Cyclizations in Epoxide Openings” Y. Morimoto, Y. Nishikawa, C. Ueba, and T. Tanaka Angew. Chem., Int. Ed. 45, 810-812 (2006);
Angew. Chem. 118, 824-826 (2006).
ABSTRACT: The switching of the usual 5-exo cyclizations of epoxide substrates to the 6-endo mode, which goes against Baldwin's rule, is demonstrated by treating bishomoepoxy alcohols with triisopropylsilyl triflate (TIPSOTf) in nitromethane (see scheme). This method is different to those previously reported in which elaborate modifications of the epoxide substrate are required to attain 6-endo cyclization.
.gif)
“Structure, Biological Activities, and Total Syntheses of 13-Hydroxy- and
13-Acetoxy-14-nordehydrocacalohastine, Novel Modified Furanoeremophilane-type
Sesquiterpenes from Trichilia Cuneata” M. Doe, T. Shibue, H. Haraguchi and Y. Morimoto Org. Lett. 7, 1765-1768 (2005).
ABSTRACT: 13-Hydroxy-14-nordehydrocacalohastine (2) and 13-acetoxy-14-nordehydrocacalohastine (3), two novel modified furanoeremophilane-type sesquiterpenes isolated from
Trichilia cuneata, showed inhibitory activities for membrane lipid peroxidation in mitochondria
and microsomes. The first, highly convergent total syntheses of new compounds
2 and 3 have also been achieved via a palladium-mediated three-component coupling
reaction between 2-iodotoluene (7), 1-penten-4-yn-3-ol (8), and diethyl ethoxymethylenemalonate (9).

“Total Synthesis and Complete Assignment of the Stereostructure of a Cytotoxic
Bromotriterpene Polyether (+)-Aurilol” Y. Morimoto, Y. Nishikawa and M.
Takaishi J. Am. Chem. Soc. 127, 5806-5807 (2005).

“Structure, Synthesis, and Biological Activity of 14-Methoxy-1,2-dehydrocacalol
Methyl Ether, a New Modified Furanoeremophilane Type Sesquiterpene from
trichilia cuneata” M. Doe, Y. Hirai, T. Kinoshita, K. Shibata, H. Haraguchi
and Y. Morimoto Chem. Lett. 33, 714-715 (2004).
“Total Synthesis of Five Cacalol Families at Different Oxidation Stages,
Modified Furanoeremophilane Sesquiterpenes from Cacalia and Senecio Species”
Y. Hirai, M. Doe, T. Kinoshita and Y. Morimoto Chem. Lett. 33, 136-137 (2004).
“Total Synthesis and Asssignment of the Double-Bond Position and Absolute
Configuration of (-)-Pyrinodemin A” Y. Morimoto, T. Iwai, S. Kitao, T.
Okita and T. Shoji Org. Lett. 5, 2611-2614 (2003).

“Stereospecific and Biomimetic Synthesis of CS and C2 Symmetric 2,5-Disubstituted
Tetahydrofuran Rings as Central Building Blocks of Biogenetically Intriguing
Oxasqualenoids” Y. Morimoto, T. Iwai, Y. Nishikawa and T. Kinoshita Tetrahedron: Asymmetry 13, 2641-2647 (2002).

“Complete Assignment of the Stereostructure of a New Squalene-Derived
Epoxy Tri-THF Diol from Spathelia glabrescens by Total Synthesis” Y. Morimoto,
M. Takaishi, T. Iwai, T. Kinoshita, H. Jacobs Tetrahedron Lett. 43, 5849-5852 (2002).

“Total Synthesis and Determination of the Stereochemistry of 2-Amino-3-cyclopropylbutanoic
Acid, a Novel Plant Growth Regulator Isolated from the Mushroom Amanita Castanopsidis Hongo” Y. Morimoto, M. Takaishi, T. Kinoshita, K. Sakaguchi and K. Shibata
Chem. Commun. 42-43 (2002).
"Synthesis and Absolute Configuration of Lactone II Isolated from
Streptomyces sp. Go 40/10" T. Ueki, Y. Morimoto and T. Kinoshita Chem. Commun. 1820-1821 (2001).
"Total Synthesis and Determination of the Absolute Configuration of
(−)-Iongilene Peroxide" Y. Morimoto, T. Iwai and T. KinoshitaTetrahedron Lett. 42, 6307-6309 (2001).

"Stereocontrolled Total Synthesis of the Stemona Alkaloid (−)-Stenine" Y. Morimoto, M. Iwahashi, T. Kinoshita and K. Nishida Chem. Eur. J. 7, 4107–4116 (2001).
“Total Synthesis of (+)-Eurylene and (+)-14-Deacetyl Eurylene” Y. Morimoto,
K. Muragaki, T. Iwai, Y. Morishita and T. Kinoshita Angew. Chem., Int. Ed. 39, 4082-4084 (2000).
“Revised Structure of Squalene-Derived Penta THF Polyether, Glabrescol, through Its Enantioselective Total Synthesis: Biogenetically Intriguing CS vs C2 Symmetric Relationships” Y. Morimoto, T. Iwai and T. Kinoshita J. Am. Chem. Soc. 122, 7124-7125 (2000).
"Can α-Sultone Exist as a Chemical Species ? First Experimental Implication
for Intermediacy of α-Sultone” Y. Morimoto, H. Kurihara and T. Kinoshita
Chem. Commun. 189-190 (2000).
“Effective Combination of Two-Directional Synthesis and Rhenium(VII) Chemistry:
Total Synthesis of meso Polyether Teurilene” Y. Morimoto, T. Iwai and T.
Kinoshita J. Am. Chem. Soc. 121, 6792-6797 (1999).
“Total Syntheses of Macrocyclic Marine Alkaloids, Haliclamines A and B:
A Convenient and Expeditious Assembly of 3-Substituted Pyridine Derivatives
with Different Alkyl Chains to the Bispyridinium Macrocycle” Y. Morimoto,
C. Yokoe, H. Kurihara and T. Kinoshita Tetrahedron 54, 12197-12214 (1998).

“Highly Diastereoselective Cyclizations of Bishomoallylic Tertiary Alcohols
Promoted by Rhenium(VII) Oxide. Critical Steric versus Chelation Effects
in Alkoxyrhenium Intermediates” Y. Morimoto and T. Iwai J. Am. Chem. Soc. 120, 1633-1634 (1998).
"Synthesis and Asolute Configuration of (+)-Hyperolactone B"
T. Ueki, D. Ichinari, K. Yoshihara, Y. Morimoto and T. Kinoshita Tetrahedron Lett. 39, 667-668 (1998).
"Diastereoselective Two-directional Synthesis and Cation Transport
Ability of the Central Tristetrahydrofuranyl Unit of Meso Polyether Glabrescol
as Naturally Occurring Podand" Y. Morimoto, T. Iwai, T. Yoshimura,
T. Kinoshita Bioorg. Med. Chem. Lett. 8, 2005-2010 (1998).
“Unexpected Stability of δ-Lactones with Axial Substituents rather than
Equatorial Ones. Conformational Evaluation by Molecular Mechanics and Molecular
Orbital Calculations” Y. Morimoto and H. Shirahama Tetrahedron 53, 2013-2024 (1997).
"Stereocontrolled Synthesis of C10-C22 Fragment of the Iimmunosuppressant
FK 506. An Occurrence of Complementary Stereoselectivity in the C15 Ketone
Reduction" Y. Morimoto, A. Mikami, S. Kuwabe and H. Shirahama Tetrahedron: Asymmetry 7, 3371-3390 (1996).
“Synthetic Studies on Virantmycin. 2. Total Synthesis of Unnatural (+)-Virantmycin
and Determination of Its Absolute Stereochemistry” Y. Morimoto and H. Shirahama
Tetrahedron 52, 10631-10652 (1996).
"Synthetic Studies on Virantmycin. 1. Total Synthesis of (±)-Virantmycin
and Determination of Its Relative Stereochemistry" Y. Morimoto, F.
Matsuda and H. Shirahama Tetrahedron 52, 10609-10630 (1996).
“Studies on the Asymmetric Synthesis of Stemona Alkaloids: Total Synthesis
of (-)-Stenine” Y. Morimoto, M. Iwahashi, K. Nishida, Y. Hayashi and H.
Shirahama Angew. Chem., Int. Ed. 35, 904-906 (1996).

学会発表 PRESENTATIONS
2024 年 ( 令和 6 年 )“ペルヒドロヒストリオニコトキシン類のニコチン性アセチルコリン受容体に対する阻害活性の構造活性相関” 日本農薬学会第 49 回大会 〇森 澄海人、西川 慶祐、小野 陽介、高山 浩一、伊原 誠、松田 一彦、森本 善樹 ( 口頭、3 月、奈良 )
“ロリトレム B の合成研究” 日本化学会第 104 春季年会 〇寺西 智徳、西川 慶祐、森本 善樹 ( 口頭、3 月、船橋 )
"Synthetic Studies on the seco-Dolastane-Type Diterpene Isolinearol” The 104th CSJ Annual Meeting (2024) 〇Tomoki Tsuruta, Yukika Yoshino, Keisuke Nishikawa, and Yoshiki Morimoto ( Oral, March, Funabashi )
このページの先頭へ
2023 年 ( 令和 5 年 )
“ペルヒドロヒストリオニコトキシンの不斉全合成” 日本化学会第 103 春季年会 〇小野 陽介、西川 慶祐、奥村 光浩、森本 善樹 ( 口頭、3 月、野田 )
“6-epi-テトロドトキシンの不斉全合成研究” 日本化学会第 103 春季年会 〇西川 慶祐、小野 陽介、田村 真一朗、森本 善樹 ( 口頭、3 月、野田 )
“トキシコデナン C の不斉合成研究” 日本化学会第 103 春季年会 〇鶴田 智暉、中尾 信之介、西川 慶祐、森本 善樹 ( 口頭、3 月、野田 )
“直鎖分子を鍵中間体とするテトロドトキシン類の全合成研究” 静岡理工科大学 研究交流セミナー 〇西川 慶祐 ( 依頼講演、口頭、6 月、静岡 )
”褐藻シワヤハズ由来抗炎症物質の構造活性相関” 第 60 回化学関連支部合同九州大会 〇松田 明奈、椎葉 望実、鶴田 智暉、西川 慶祐、加藤 早苗、 熊谷 百慶 ( ポスター、7 月、北九州 )
"Structure-Activity Relationship of Perhydrohistrinicotoxins for Inhibition of the α4β2 Nicotinc Acetylcholine Receptors” Control of Human Disease Vectors, Pests and Parasites: Meeting the Challenges of Resistance and Sustainability 〇S. Mori, K. Nishikawa, Y. Ono, K. Takayama, M. Ihara, K. Matsuda, and Y. Morimoto ( Oral, September, Cambridge, UK )
“紅藻由来トリテルペンポリエーテル、ニバリオールの全合成研究” 第 43 回有機合成若手セミナー「 明日の有機合成を担う人のために 」〇中尾 信之介、西川 慶祐、林 幹史朗、森本 善樹 ( ポスター、8 月、京都 )
“フグ毒テトロドトキシンの不斉全合成研究” 第 43 回有機合成若手セミナー「 明日の有機合成を担う人のために 」〇小野 陽介、西川 慶祐、安田 陸人、森本 善樹 ( ポスター、8 月、京都 )
“Lolitrem Bの合成研究” 第 4 3回有機合成若手セミナー「 明日の有機合成を担う人のために 」〇寺西 智徳、西川 慶祐、森本 善樹 ( ポスター、8 月、京都 )
“イガイの足糸形成を阻害する seco-ドラスタン型ジテルペン Isolinearol の合成研究" 第 43 回有機合成若手セミナー「 明日の有機合成を担う人のために 」〇鶴田 智暉、吉野 優季花、西川 慶祐、森本 善樹 ( ポスター、8 月、京都 )
“アザスピロ環一挙構築反応を用いたヒストリオニコトキシン類の不斉全合成とニコチン性アセチルコリン受容体の阻害活性” 第 65 回天然有機化合物討論会 〇小野 陽介、西川 慶祐、松村 匡浩、森 澄海人、高山 浩一、伊原 誠、松田 一彦、森本 善樹 ( 口頭、9 月、東京 )
"Establishment of “Ring-Size-Divergent” Synthetic Strategy of Terpenoids Having Five-, Six-, and Seven-Membered Ether Rings from Identical Polyepoxides” The 15th International Kyoto Conference on New Aspects of Organic Chemistry ( IKCOC-15 ) 〇T. Teranishi, K. Nishikawa, T. Niwa, K. Morita, S. Hashimoto, A. Hoshino, and Y. Morimoto, ( Poster, November, Kyoto )
“Studies on Total Synthesis of the Dolastane-Type Diterpene Possessing Inhibition Activity against Byssal Threads of the Mussel” The 15th International Kyoto Conference on New Aspects of Organic Chemistry ( IKCOC-15 ) 〇T. Tsuruta, Y. Yoshino, K. Nishikawa, and Y. Morimoto ( Poster, November, Kyoto )
“含臭素トリテルペノイド、カリクラドールの不斉全合成、立体構造の決定、細胞毒性評価” 第 67 回香料・テルペンおよび精油化学に関する討論会 〇西川 慶祐、錦部 健人、熊谷 百慶、森本 善樹 ( 口頭、10 月、千葉 )
“生物が生み出す天然有機化合物の世界” 大阪公立大学 文化交流センター専門家講座 〇森本 善樹 ( 依頼講演、口頭、12 月、大阪 )
このページの先頭へ
2022 年 ( 令和 4 年 )
"含窒素スピロ環一挙構築反応を用いたヒストリオニコトキシン235A の不斉全合成:鍵直鎖分子の検討" 日本化学会第 102 春季年会 〇伏井 雄一郎、西川 慶祐、松村 匡浩、森本 善樹( 口頭、3 月、オンライン )
"二枚貝の足糸形成を阻害するドラスタン型ジテルペンの不斉全合成研究" 日本化学会第 102 春季年会 〇鶴田 智暉、西川 慶祐、森本 善樹 ( 口頭、3 月、オンライン)
"ジエポキシドからのジオキサビシクロ [3.2.1] オクタン骨格一挙構築反応の確立" 日本化学会第 102 春季年会〇林 幹史朗、西川 慶祐、寺西 智徳、森本 善樹 ( 口頭、3 月、オンライン )
"ペルヒドロヒストリオニコトキシンの不斉全合成研究" 日本化学会第 102 春季年会 〇小野 陽介、西川 慶祐、伏井 雄一郎、森本 善樹 ( 口頭、3 月、オンライン)
“直鎖状分子からの環骨格一挙構築を基盤とした天然物合成戦略” 若手研究者のための有機化学札幌セミナー 〇西川 慶祐 ( 招待講演、口頭、7 月、オンライン )
”分子内還元的求核付加を鍵とするドラスタン型ジテルペンの合成研究” 第 42 回有機合成若手セミナー 「 明日の有機合成を担う人のために 」 ○鶴田 智暉、小林 謙太、西川 慶祐、森本 善樹 ( 口頭、8 月、オンライン )
"ペルヒドロヒストリオニコトキシンの不斉全合成研究" 第 42 回有機合成若手セミナー 「 明日の有機合成を担う人のために 」 〇小野 陽介、西川 慶祐、伏井 雄一郎、奥村 光浩、森本 善樹 ( 口頭、8 月、オンライン )
"6-epiテトロドトキシンの全合成研究" 第 42 回有機合成若手セミナー 「 明日の有機合成を担う人のために 」 〇田村 真一朗、西川 慶祐、森本 善樹 ( 口頭、8 月、オンライン )
"“リングサイズ発散” 合成法の確立: 5 ~ 7 員環エーテルをもつテルペノイド類の全合成、構造改訂、絶対配置の決定、生物活性" 第 64 回天然有機化合物討論会 ○西川 慶祐、寺西 智徳、林 幹史郎、丹羽 俊揮、森田 健吾、橋本 統星、熊谷 百慶、森本 善樹 ( 口頭、9 月、静岡 )
“二枚貝の足糸形成を阻害するドラスタン型ジテルペンの合成研究” 第 66 回 香料・テルペンおよび精油化学に関する討論会 ○鶴田 智暉、小林 謙太、西川 慶祐、森本 善樹 ( 口頭、11 月、沖縄 )
“細胞毒性含臭素トリテルペノイド、ユーボールの全合成、構造修正、絶対配置の決定、構造活性相関” 第 66 回 香料・テルペンおよび精油化学に関する討論会 ○西川 慶祐、滝 直人、熊谷 百慶、森本 善樹 ( 口頭、11 月、沖縄 )
このページの先頭へ
2021 年 ( 令和 3 年 )
”直鎖分子からの環骨格一挙構築を鍵工程とした天然物合成戦略” 一般社団法人近畿化学協会合成部会主催 第 2 回合成フォーラム [ テーマ:若い世代の有機合成 ] ○西川 慶祐 ( 招待講演、口頭、1 月、オンライン )
“抗腫瘍性海洋天然物カリクラドールの不斉全合成と構造決定” 日本化学会第 101 春季年会 〇錦部 健人、西川 慶祐、森本 善樹 ( 口頭、3 月、オンライン )
“ヨウ化サマリウムを用いたドラスタン型ジテルペンの合成研究” 日本化学会第 101 春季年会 〇鶴田 智暉、菊田 弘毅、西川 慶祐、森本 善樹 ( 口頭、3 月、オンライン )
“(+)- および (−)-トキシコデナン A の不斉全合成” 日本化学会第 101 春季年会 〇菊田 弘毅、鶴田 智暉、菅原 翔、久米 真司、西川 慶祐、森本 善樹 ( 口頭、3 月、オンライン )
”(−)-Tetrodotoxinの合成研究” 日本化学会第 101 春季年会 〇安田 陸人、野口 隆幸、西川 慶祐、森本 善樹 ( 口頭、3 月、オンライン )
”カリクラドールの全合成と全立体構造の決定” 第 41 回有機合成若手セミナー 「 明日の有機合成を担う人のために 」○錦部 健人、西川 慶祐、森本 善樹 ( 口頭、8 月、オンライン )
””リングサイズ発散”合成戦略の確立とネロリドール型セスキテルペノイド類の発散合成” 第 41 回有機合成若手セミナー 「 明日の有機合成を担う人のために 」○寺西 智徳、西川 慶祐、松浦 晃久、森田 健吾、橋本 統星、森本 善樹 ( 口頭、8 月、オンライン )
"含窒素スピロ環一挙構築反応によるヒストリオニコトキシン 235A の不斉全合成” 第 41 回有機合成若手セミナー 「 明日の有機合成を担う人のために 」 〇伏井 雄一郎、松村 匡浩、西川 慶祐、森本 善樹 ( 口頭、8 月、オンライン )
”二枚貝の足糸形成を阻害するドラスタン型ジテルペンの合成研究” 第 41 回有機合成若手セミナー 「 明日の有機合成を担う人のために 」 ○鶴田 智暉、西川 慶祐、森本 善樹 ( 口頭、8 月、オンライン )
“紆余曲折を経て今日に至る~大阪の大学教員が、北海道の院生に伝えたいこと~” 「 北海道大学 大学院環境科学院・環境科学同窓会 」イベント ホームカミングデー 2021 〇西川 慶祐 ( 口頭,9 月、オンライン )
”カリクラドールの不斉全合成と構造決定” 第 63 回天然有機化合物討論会 ○錦部 健人、西川 慶祐、熊谷 百慶、 森本 善樹 ( 口頭、9 月、大阪 )
"“リングサイズ発散”合成戦略の確立と天然物合成への応用" 第 50 回複素環化学討論会 ○寺西 智徳、西川 慶祐、丹羽 俊揮、森田 健吾、橋本 統星、松浦 晃久、森本 善樹 ( 口頭、10 月、オンライン )
"含窒素スピロ環一挙構築反応を用いたヒストリオニコトキシン 235A の不斉全合成” 第 50 回複素環化学討論会○伏井 雄一郎、松村 匡浩、西川 慶祐、森本 善樹 ( ポスター、10 月、オンライン )
"“リングサイズ発散”合成戦略の確立と天然物合成への応用" 第 11 回 CSJ 化学フェスタ 2021 ○寺西 智徳、西川 慶祐、丹羽 俊揮、森田 健吾、橋本 統星、松浦 晃久、森本 善樹 ( ポスター、10 月、オンライン )
”含窒素スピロ環一挙構築反応を用いたヒストリオニコトキシン 235A の不斉全合成” 第 11 回 CSJ 化学フェスタ 2021 ○伏井 雄一郎、松村 匡浩、西川 慶祐、森本 善樹 ( ポスター、10 月、オンライン )
“直鎖分子からの環骨格一挙構築を基盤とした天然物合成戦略” 第 19 回有機合成化学協会 関西支部賞受賞講演会〇西川 慶祐 ( 口頭、11 月,オンライン )
“Establishment of "Ring Size Divergant" Synthetic Method of Terpenoids Having Five, Six, and Seven-Membered Ether Rings from Identical Polyepoxides” The 2021 International Chemical Congress of Pacific Basin Societies (Pacifichem 2021) ○K. Nishikawa, T. Niwa, A. Matsuura, K. Nishikibe, K. Morita, S. Hashimoto, A. Hoshino, and Y. Morimoto (Poster, December, Online)
このページの先頭へ
2020 年 ( 令和 2 年 )
“同じポリエポキシドから 5 ~ 7 員環エーテルをもつテルペノイド類のリングサイズ発散合成法の確立” 新学術領域研究 「 反応集積化が導く中分子戦略 : 高次生物機能分子の創製 」 第 9 回成果報告会 ○西川 慶祐、森本 善樹 ( ポスター、1 月、大阪 )
“(+)-トキシコデナン A の不斉全合成” 日本化学会第 100 春季年会 〇菊田 弘毅、西川 慶祐、森本 善樹 ( 口頭、3 月、野田 )
“Feroniellin 類の短段階発散的合成と構造改訂” 日本化学会第 100 春季年会 〇丹羽 俊揮、錦部 健人、西川 慶祐、森本 善樹 ( 口頭、3 月、野田 )
“ヒストリオニコトキシン 235A の不斉全合成” 日本化学会第 100 春季年会 〇松村 匡浩、西川 慶祐、吉田 浩明、伏井 雄一郎、森本 善樹 ( 口頭、3 月、野田 )
“ジエポキシドの環化モードの切り替え反応を用いた、ネロリドール型セスキテルペノイド類の発散的合成と構造改訂” 日本化学会第 100 春季年会 〇松浦 晃久、池内 拓海、西川 慶祐、森本 善樹 ( 口頭、3 月、野田 )
“Suggestion of the Relative Configuration of a Red Alga-Derived Polyether Callicladol Based on the Model Synthesis” 日本化学会第 100 春季年会 〇Kento Nishikibe, Keisuke Nishikawa, and Yoshiki Morimoto ( 口頭、3 月、野田 )
“直鎖分子からの環骨格一挙構築をコンセプトとした天然物合成戦略 ( Natural Product Synthesis Strategy Based on the Concept of Direct Constructing the Ring Skeleton from a Linear Substrate )” 日本化学会第 100 春季年会 第 34 回若い世代の特別講演会 〇西川 慶祐 ( 招待講演、口頭、3 月、野田 )
”海洋天然物の全合成からエナンチオ発散現象との遭遇へ” 第 40 回有機合成若手セミナー 「 明日の有機合成を担う人のために 」 〇森本 善樹 ( 招待講演、口頭、8 月、オンライン )
"(+)-トキシコデナン A の不斉全合成” 第 62 回天然有機化合物討論会 西川 慶祐、○菊田 弘毅、中務 人誌、福山 裕香、森本 善樹 ( ショートプレゼンとポスター、9 月、オンライン )
“毒をもって毒を制す!複雑な構造をもつ天然物の化学合成に挑む!” 大阪市立大学理学部主催 理学部教員による職員向け談話会 ○西川 慶祐 ( 依頼講演、口頭、12 月、大阪 )
このページの先頭へ
2019 年 ( 平成 31 年 ➡ 令和元年 )
"Tetrodotoxin 骨格の合成” 日本化学会第 99 春季年会 ○野口 隆幸、武田 莉奈、丸山 高弘、荒木 勇介、西川 慶祐、森本 善樹 ( 口頭、3 月、神戸 )
“抗腫瘍活性を示す海洋産トリテルペ ンポリエーテル (ー)-アプリシオール B と (+)-サイヤセノール A の不斉全合成及び構造決定” 第 54 回天然物化学談話会 〇錦部 健人、熊谷 百慶、西川 慶祐、森本 善樹 ( ポスター、7 月、札幌 )
“トキシコデナン A の不斉全合成” 第 39 回有機合成若手セミナー 「 明日の有機合成を担う人のために 」〇菊田弘毅、中務人誌、 福山裕香、西川慶祐、森本善樹 ( ポスター、8 月、堺 ) 優秀研究発表賞 受賞
“紅藻由来細胞毒性ポリエーテル Callicladol の全立体構造の決定” 第 39 回有機合成若手セミナー 「 明日の有機合成を担う人のために 」○錦部 健人、西川 慶祐、森本 善樹 ( ポスター、8 月、堺 )
“カエル毒ヒストリオニコトキシン類の不斉全合成研究” 第 39 回有機合成若手セミナー 「 明日の有機合成を担う人のために 」○松村 匡浩、吉田 浩明、小山 智之、丹羽 俊揮、高見 麻衣、伏井 雄一郎、西川 慶祐、森本 善樹 ( ポスター、8 月、堺 )
“Feroniellin 類の短段階合成と構造改訂” 第 39 回有機合成若手セミナー 「 明日の有機合成を担う人のために 」○丹羽 俊揮、西川 慶祐、森本 善樹 ( ポスター、8 月、堺 )
“ジエポキシドの水中環化反応による環化生成物の絶対配置及び生成機構の解明” 第 39 回有機合成若手セミナー 「 明日の有機合成を担う人のために 」○池内 拓海、西川 慶祐、森本 善樹 ( ポスター、8 月、堺 )
“Asymmetric Total Synthesis and Structural Elucidation of Marine Triterpene Polyethers (−)-Aplysiol B and (+)-Saiyacenol A with Potent Antitumor Activity” 27th International Society of Heterocyclic Chemistry Congress ○Kento Nishikibe, Momochika Kumagai, Moe Tokita, Naoto Taki, Keisuke Nishikawa, and Yoshiki Morimoto ( Poster, September, Kyoto )
“Total Synthesis of Histrionicotoxin 235A” 27th International Society of Heterocyclic Chemistry Congress ○Kunihiro Matsumura, Keisuke Nishikawa, Hiroaki Yoshida, Tomoyuki Koyama, Toshiki Niwa,
Mai Takami, and Yoshiki Morimoto ( Flash Presentation and Poster, September, Kyoto )
“Studies on Total Synthesis of Polycitorol A Utilizing Hg(OTf)2-Catalyzed Cycloisomerization Reaction” 27th International Society of Heterocyclic Chemistry Congress ○Priscilla Yoong Mei Yen, Keisuke Nishikawa, and Yoshiki Morimoto ( Poster, September, Kyoto )
“酸性水媒体および中性水中下におけるポリエポキシド環化様式のクリティカルスイッチング: ネロリドールセスキテルペノイドおよびフェロニエリン類の合成と構造改訂” 第 61 回天然有機化合物討論会 〇西川 慶祐、森田 健吾、橋本 統星、星野 晃大、池内 拓海、丹羽 俊揮、森本 善樹 ( ショートプレゼンとポスター、9 月、広島 )
“トキシコデナン A の不斉全合成” 第 63 回 香料・テルペンおよび精油化学に関する討論会 ○菊田 弘毅、中務 人誌、福山 裕香、西川 慶祐、森本 善樹 ( 口頭、9 月、秋田 )
“抗腫瘍活性を示す海洋産トリテルペンポリエーテル (–)-アプリシオール B と (+)-サイヤセノール A の不斉全合成及び構造決定” 第 63 回 香料・テルペンおよび精油化学に関する討論会 ○錦部 健人、熊谷 百慶、西川 慶祐、森本 善樹 ( 口頭、9 月、秋田 )
“酸性水媒体および中性水中下におけるポリエポキシド環化様式のクリティカルスイッチング: ネロリドールセスキテルペノイドおよびフェロニエリン類の合成と構造改訂” 第 63 回 香料・テルペンおよび精油化学に関する討論会 ○西川 慶祐、森田 健吾、橋本 統星、星野 晃大、錦部 健人、池内 拓海、丹羽 俊揮、森本 善樹 ( 口頭、9 月、秋田 )
“含窒素スピロ環一挙構築を鍵とする Tetrodotoxin 骨格の合成” 第 116 回有機合成シンポジウム 2019 年【 秋 】〇野口 隆幸、武田 莉奈、丸山 高弘、荒木 勇介、西川 慶祐、森本 善樹 ( 口頭とポスター、10-11 月、東京 )
“Asymmetric Total Synthesis and Structural Elucidation of Marine Triterpene Polyethers (−)-Aplysiol B and (+)-Saiyacenol A with Potent Antitumor Activity” 〇Kento Nishikibe, Keisuke Nishikawa, and Yoshiki Morimoto, 18th Asian Chemical Congress (18th ACC) ( Poster, November, Taipei )
“Studies on Total Synthesis of Polycitorol A Utilizing Hg(OTf)2-Catalyzed Cycloisomerization Reaction” 〇Priscilla Yoong Mei Yen, Keisuke Nishikawa, and Yoshiki Morimoto, 18th Asian Chemical Congress (18th ACC) ( Poster, November, Taipei )
このページの先頭へ
2018 年 ( 平成 30 年 )
"海洋産ポリエーテル Saiyacenol A の全合成” 日本化学会第 98 春季年会 〇錦部 健人、西川 慶祐、森本 善樹 ( 口頭、3 月、船橋 )
”中性水中環化反応を用いたネロリドール型セスキテルペノイドの不斉全合成” 日本化学会第 98 春季年会 〇森田 健吾、橋本 統星、星野 晃大、竹内 絵里子、西川 慶祐、森本 善樹 ( 口頭、3 月、船橋 )
”Tetrodotoxin の全合成研究” 日本化学会第 98 春季年会 〇武田 莉奈、荒木 勇介、菊池 正峰、吉山 春香、西川 慶祐、森本 善樹 ( 口頭、3 月、船橋 )
"Synthetic Studies on Toxicodenane A” 日本化学会第 98 春季年会 〇Hitoshi Nakatsukasa, Yuuka Fukuyama, Keisuke Nishikawa, and Yoshiki Morimoto ( ポスター、3 月、船橋 )
”Formal Total Synthesis of Histrionicotoxin” 日本化学会第 98 春季年会 〇Kunihiro Matsumura, Hiroaki Yoshida, Tomoyuki Koyama, Keisuke Nishikawa, and Yoshiki Morimoto ( 口頭、3 月、船橋 )
”ヒストリオニコトキシン類の合成研究” 第 16 回次世代を担う有機化学シンポジウムプログラム 〇松村 匡浩,吉田 浩明,高見 麻衣,小山 智之,西川 慶祐,森本 善樹 ( 口頭、5 月、大阪 )
“サイヤセノール A の全合成” 第 38 回有機合成若手セミナー 「 明日の有機合成を担う人のために 」〇西川 慶祐、錦部 健人、森本 善樹 ( ポスター、8 月、西宮 )
“ヒストリオニコトキシン 235A の全合成” 第 38 回有機合成若手セミナー 「 明日の有機合成を担う人のために 」 〇松村 匡浩、西川 慶祐、吉田 浩明、高見 麻衣、丹羽 俊輝、小山 智之、森本 善樹 ( ポスター、8 月、西宮 ) 優秀研究発表賞 受賞
“海洋産細胞毒性ポリエーテル群の構造活性相関研究” 第 38 回有機合成若手セミナー 「 明日の有機合成を担う人のために 」 〇尾方 勇太、錦部 健人、滝 直人、熊谷 百慶、西川 慶祐、森本 善樹 ( ポスター、8 月、西宮 )
“Tetrodotoxin 骨格の合成研究” 第 38 回有機合成若手セミナー 「 明日の有機合成を担う人のために 」 〇野口 隆幸、荒木 勇介、丸山 高弘、西川 慶祐、森本 善樹 ( ポスター、8 月、西宮 )
“細胞毒性含臭素トリテルペノイド、サイヤセノール A の全合成” 第 5 回 新学術領域研究 「 反応集積化が導く中分子戦略: 高次生物機能分子の創製 」 若手シンポジウム 〇西川 慶祐 ( 口頭、8 月、神戸 )
“水銀トリフラート触媒を用いた 1-アザスピロ [5.5] ウンデカン骨格の一挙構築によるヒストリオニコトキシン 235A の全合成” 第 60 回天然有機化合物討論会 〇松村 匡浩、吉田 浩明、高見 麻衣、小山 智之、西川 慶祐、森本 善樹 ( 口頭、9 月、久留米 )
“Total Synthesis of Histrionicotoxin 235A” 〇Kunihiro Matsumura, Hiroaki Yoshida, Tomoyuki Koyama, Toshiki Niwa, Keisuke Nishikawa, and Yoshiki Morimoto, The 14th International Kyoto Conference on New Aspects of Organic Chemistry ( IKCOC-14 ) ( Poster, November, Kyoto )
このページの先頭へ
2017 年 (平成 29 年)
"Tetrodotoxin の全合成研究" 日本化学会第 97 春季年会 ○武田 莉奈、服部 大志、荒木 勇介、菊池 正峰、吉山 春香、西川 慶祐、森本 善樹 ( 口頭、3 月、横浜 )
"ヒストリオニコトキシン類の合成研究" 日本化学会第 97 春季年会 ○松村 匡浩、小山 智之、西川 慶祐、森本 善樹 ( 口頭、3 月、横浜 )
"海洋産ポリエーテル Aplysiol B の全合成及び構造改訂" 日本化学会第 97 春季年会 ○錦部 健人、鴇田 百栄、滝 直人、西川 慶祐、森本 善樹 ( 口頭、3 月、横浜 )
"ポリエポキシドの水中環化反応の開発と天然物合成への応用" 日本化学会第 97 春季年会 ○橋本 統星、星野 晃大、竹内 絵里子、西川 慶祐、森本 善樹 ( 口頭、3 月、横浜 )
"Structure-Activity Relationship Studies on Marine Cytotoxic Polyethers" 日本化学会第 97 春季年会 ○Y. Ogata, K. Nishikibe, M. Tokita, N. Taki, K. Nishikawa, and Y. Morimoto ( ポスター、3 月、横浜 )
"テトロドトキシン骨格の合成研究" 日本化学会第 97 春季年会、○荒木 勇介、丸山 高弘、菊池 正峰、小山 智之、西川 慶祐、森本 善樹 ( ポスター、3 月、横浜 )
"水銀トリフラート触媒による6,6-スピロ環化反応を鍵工程とするヒストリオニコトキシンの全合成研究" 日本化学会第97春季年会 ○吉田浩明、小山智之、西川慶祐、森本善樹 (ポスター、3月、横浜)
"5,6-Dehydrokawain 誘導体の合成と破骨細胞分化抑制作用" 日本農芸化学会 2017 年度大会 ○熊谷 百慶、西川 慶祐、三嶋 隆、吉田 泉、井出 将博、小泉 慶子、中村 宗知、森本 善樹 (口頭、3月、京都)
"ヒストリオニコトキシンの形式全合成" 第 37 回有機合成若手セミナー「 明日の有機合成を担う人のために 」
〇松村 匡浩、吉田 浩明、西川 慶祐、森本 善樹 ( ポスター、8 月、京都 )
"海洋産ポリエーテル Aplysiol B の全合成と構造改訂および細胞毒性評価" 第 37 回有機合成若手セミナー「 明日の有機合成を担う人のために 」○錦部 健人、鴇田 百栄、滝 直人、熊谷 百慶、西川 慶祐、森本 善樹 ( ポスター、8 月、京都 )
"Tetrodotoxin の全合成研究" 第 37 回有機合成若手セミナー「 明日の有機合成を担う人のために 」○武田 莉奈、荒木 勇介、丸山 高弘、菊池 正峰、吉山 春香、西川 慶祐、森本 善樹 ( ポスター、8 月、京都 ) 優秀研究発表賞
"トキシコデナン A の全合成研究" 第 37 回有機合成若手セミナー「 明日の有機合成を担う人のために 」〇中務 人誌、福山 裕香、西川 慶祐、森本 善樹 ( ポスター、8 月、京都 )
"中性水中環化反応を用いたネロリドール型セスキテルペンの全合成と構造改訂" 第 37 回有機合成若手セミナー「 明日の有機合成を担う人のために 」〇森田 健吾、橋本 統星、星野 晃大、西川 慶祐、森本 善樹 ( ポスター、8 月、京都 )
"22-ヒドロキシ-15(28)-デヒドロベヌスタトリオールの全合成と構造改訂、およびエナンチオ発散現象" 第 37 回有機合成若手セミナー「 明日の有機合成を担う人のために 」○西川 慶祐、錦部 健人、鴇田 百栄、滝 直人、森本 善樹 ( ポスター、8 月、京都 )
"チルシフェロール類共通骨格のエナンチオ発散現象:アプリシオール B 及び 22-ヒドロキシ-15(28)-デヒドロベヌスタトリオールの全合成と構造改訂" 第 59 回天然有機化合物討論会 錦部 健人、鴇田 百栄、滝 直人、○西川 慶祐、森本 善樹 ( 口頭、9 月、札幌 )
"ヒストリオニコトキシンの形式全合成" 第 7 回 CSJ 化学フェスタ 2017 ○松村 匡浩、吉田 浩明、西川 慶祐、森本 善樹 ( ポスター、10 月、東京 ) 優秀ポスター発表賞
"Tetrodotoxin の全合成研究" 第 47 回複素環化学討論会 ○武田 莉奈、荒木 勇介、丸山 高弘、菊池 正峰、吉山 春香、西川 慶祐、森本 善樹 ( 口頭、10 月、高知 )
"ヒストリオニコトキシンの形式全合成" 第 47 回複素環化学討論会 ○松村 匡浩、吉田 浩明、西川 慶祐、森本 善樹 ( ポスター、10 月、高知 )
"中性水中環化反応を用いたネロリドール型セスキテルペンの全合成と構造改訂" 第 112 回有機合成シンポジウムプログラム ○森田 健吾、橋本 統星、星野 晃大、西川 慶祐、森本 善樹 ( ポスター、11 月、東京 )
このページの先頭へ

2016年 (平成28年)
"Examination of the New Synthetic Strategy for Tetrodotoxins on the Basis of Mercury(II) Triflate-catalayzed Cycloisomerization" 第96化学会春季年会 ○T. Maruyama, S. Kikuchi, T. Koyama, K. Nishikawa, Y. Tachi and Y. Morimoto (口頭、3月、京田辺)
"水銀(II)トリフラート触媒を用いた環化異性化反応による6,6-スピロ化合物の合成” 第96化学会春季年会 ○吉田浩明、丸山高弘、小山智之、西川慶祐、舘祥光、森本善樹 (口頭、3月、京田辺)
“レパジホルミン C の全合成研究” 第96化学会春季年会 ○山内健吾、菊池正峰、江崎伸之介、小山智之、西川慶祐、舘祥光、森本善樹 (口頭、3月、京田辺)
“海洋産紅藻Laurencia viridisから単離された 22-ヒドロキシ-15(28)-デヒドロベヌスタトリオールの不斉全合成研究" 第96化学会春季年会 ○鴇田百栄、滝直人、中井遥、星野晃大、森野光耶子、西川慶祐、舘祥光、森本善樹(ポスター、3月、京田辺)
"着生阻害活性を持つドラスタン型ジテルペン類の全合成研究” 第96化学会春季年会 ○福山裕香、西川慶祐、舘祥光、森本善樹 (ポスター、3月、京田辺)
“アルキル鎖を伸長した三脚型配位子を用いた銅錯体の合成と置換基効果” 第96化学会春季年会 ○榎本凌、角高海理、西川慶祐、森本善樹、舘祥光 (口頭、3月、京田辺)
"Elucidation of Formation Mechanism for Coordination Polymer Supported by Copper-Tripodal Triheteroatyl Ligand System" 第96化学会春季年会 ○K. Kakutaka, R. Enomoto, K. Nishikawa, Y. Morimoto and Y. Tachi (口頭、3月、京田辺)
"月桃(Alpinia zerumbet)由来5,6-dehydrokawainによるマウス骨芽細胞様MC3T3-E1細胞の分化促進作用" 日本農芸化学会2016年度大会 ○熊谷百慶、三嶋隆、渡辺章夫、原田哲平、井出将博、小泉慶子、吉田泉、藤田和弘、渡井正俊、多和田真吉、西川慶祐、森本善樹 (ポスター、3月、札幌)
“紅藻マギレソゾLaurencia saitoi由来ブロモペルオキシダーゼの臭素化反応” 日本農芸化学会2016年度大会 ○正木志良、金子賢介、小林大毅、石川高史、西川慶祐、森本善樹、鷲尾健司、森川正章、沖野龍文 (ポスター、3月、札幌)
"Aplysiol Bの全合成と構造改訂" 第51回天然物化学談話会 ○錦部健人 (ポスター、7月、越後湯沢)
"π電子親和性触媒による環化異性化反応を鍵とするヒストリオニコトキシン類の全合成研究" 第51回天然物化学談話会 ○松村匡浩 (ポスター、7月、越後湯沢)
"紅藻マギレソゾLaurencia saitoi由来トリテルペノイドの臭素付加機構" 第11回化学生態学研究会 ○正木志良、金子賢介、西川慶祐、森本善樹、鷲尾健司、森川正章、沖野龍文 (ポスター、7月、函館)
"ヒストリオニコトキシン類の合成研究" 第36回有機合成若手セミナー「明日の有機合成を担う人のために」○松村匡浩、吉田浩明、西川慶祐、舘祥光、森本善樹 (ポスター、8月、京都)
"Aplysiol Bの全合成研究" 第36回有機合成若手セミナー「明日の有機合成を担う人のために」○錦部健人、鴇田百栄、滝直人、中井遥、西川慶祐、舘祥光、森本善樹 (ポスター、8月、京都)
"水銀(II)トリフラート触媒による新奇環化異性化反応を用いた6,6-スピロ環化合物の合成" 第36回有機合成若手セミナー「明日の有機合成を担う人のために」○吉田浩明、小山智之、西川慶祐、舘祥光、森本善樹 (ポスター、8月、京都)
"Lapidilectine Bの合成研究" 第36回有機合成若手セミナー「明日の有機合成を担う人のために」○森田健吾、岩﨑和弘、西川慶祐、舘祥光、森本善樹 (ポスター、8月、京都)
"レパジホルミン類の全合成と細胞毒性評価" 第36回有機合成若手セミナー「明日の有機合成を担う人のために」○山内健吾、菊池正峰、江崎伸之介、小山智之、野久保春華、西川慶祐、舘祥光、森本善樹 (ポスター、8月、京都)
"着生阻害活性を持つドラスタン型ジテルペンの全合成研究" 第36回有機合成若手セミナー「明日の有機合成を担う人のために」○福山裕香、西川慶祐、舘祥光、森本善樹 (ポスター、8月、京都)
"水銀触媒による環化異性化反応を応用したテトロドトキシン骨格の合成研究" 第36回有機合成若手セミナー「明日の有機合成を担う人のために」○荒木勇介、丸山高弘、菊池正峰、小山智之、西川慶祐、舘祥光、森本善樹 (ポスター、8月、京都)
"月桃に含まれる骨芽細胞分化促進物質5,6-dehydrokawainの作用機序解明に向けた分子プローブの創生" 日本食品科学工学会第63回大会 ○熊谷百慶、三嶋隆、吉田泉、井出将博、小泉慶子、渡井正俊、西川慶祐、森本善樹 (口頭、8月、名古屋)
"Studies on Total Synthesis of Dolastane-type Diterpenes Possessing Antifouling Activity" The 20th Osaka City University International Conference (20th OCUIC) on Molecular Spins and Quantum Technology, ○Y. Fukuyama, K. Nishikawa, Y. Tachi, and Y. Morimoto (Poster, August–September, Osaka)
"Studies on Total Synthesis of Histrionicotoxins" The 20th Osaka City University International Conference (20th OCUIC) on Molecular Spins and Quantum Technology, ○K. Matsumura, K. Nishikawa, Y. Tachi, and Y. Morimoto (Poster, August–September, Osaka)
"Synthesis of 6,6-Spiro Cyclic Products Utilizing Mercury(II) Triflate-Catalyzed Cycloisomerization" The 20th Osaka City University International Conference (20th OCUIC) on Molecular Spins and Quantum Technology, ○H. Yoshida, T. Koyama, K. Nishikawa, Y. Tachi, and Y. Morimoto (Poster, August–September, Osaka).
"Total Synthesis of Lepadiformine Marine Alkaloids and the Evaluation of Cytotoxic Activities" The 20th Osaka City University International Conference (20th OCUIC) on Molecular Spins and Quantum Technology, ○K. Yamauchi, S. Kikuchi, S. Ezaki, T. Koyama, K. Nishikawa, Y. Tachi, and Y. Morimoto (Poster, August–September, Osaka)
"Synthetic Studies on Tetrodotoxin Model Compound" The 20th Osaka City University International Conference (20th OCUIC) on Molecular Spins and Quantum Technology, ○Y. Araki, T. Maruyama, S. Kikuchi, K. Nishikawa, Y. Tachi, and Y. Morimoto (Poster, August–September, Osaka)
"Total Synthesis and Structural Revision of Marine Polyether Aplysiol B" The 20th Osaka City University International Conference (20th OCUIC) on Molecular Spins and Quantum Technology, ○K. Nishikibe, M. Tokita, N. Taki, K. Nishikawa, Y. Tachi, and Y. Morimoto (Poster, August–September, Osaka)
"月桃由来5,6-dehydrokawainの骨粗鬆症予防効果とその作用機序解明に向けた構造活性相関研究" 第58回天然有機化合物討論会 ○熊谷百慶、三嶋隆、吉田泉、井出将博、小泉慶子、渡井正俊、西川慶祐、森本善樹 (ポスター、9月、仙台)
"水銀トリフラート触媒を用いた環化異性化反応を鍵反応とするヒストリオニコトキシン類の合成研究" 第110回有機合成シンポジウム ○松村匡浩、西川慶祐、舘祥光、森本善樹 (ポスター、11月、東京)
"Aplysiol Bの全合成及び構造の改訂" 第110回有機合成シンポジウム ○錦部健人、鴇田百栄、滝直人、中井遥、西川慶祐、舘祥光、森本善樹 (口頭、11月、東京)
"π電子親和性触媒を用いたスピロ環骨格構築法を鍵とするカエル毒の全合成研究" 第6回CSJ化学フェスタ2016 ○松村匡浩、西川慶祐、舘祥光、森本善樹 (ポスター、11月、東京)
このページの先頭へ

2015年 (平成27年)
"Studies on Total Synthesis of Tetrodotoxin" The 18th Osaka City University International Conference (18th OCUIC) ○S. Kikuchi, H. Yoshiyama, K. Nishikawa, Y. Tachi and Y. Morimoto (Poster, March, Osaka)
"Asymmetric Total Synthesis of Marine Cytotoxic Polyether Iubol and the Structural Revision of its Stereochemistry" The 18th Osaka City University International Conference (18th OCUIC) ○N. Taki, M. Tokita, H. Nakai, A. Hoshino, M. Morino, K. Nishikawa, Y. Tachi and Y. Morimoto (Poster, March, Osaka)
"Synthetic Studies on Tetrodotoxin Model Compound Using Mercury(II) Triflate-Catalayzed Novel Cycloisomerization" The 18th Osaka City University International Conference (18th OCUIC) ○T. Maruyama, S. Kikuchi, T. Koyama, K. Nishikawa, Y. Tachi, Y. Morimoto (Poster, March, Osaka)
"Asymmetric Total Synthesis of 22-Hydroxy-15(28)-dehydrovenustatriol Isolated from Marine Red Alga Laurencia viridis" The 18th Osaka City University International Conference (18th OCUIC) ○M. Tokita, N. Taki, H. Nakai, A. Hoshino, M. Morino, K. Nishikawa, Y. Tachi and Y. Morimoto (Poster, March, Osaka)
"Studies on Total Synthesis of Lepadiformines Using Mercury(Ⅱ) Triflate-Catalyzed Novel Cycloisomerization as a Key Step" The 18th Osaka City University International Conference (18th OCUIC) ○K. Yamauchi, S. Kikuchi, S. Ezaki, T. Koyama, H. Nokubo, T. Kodama, K. Nishikawa, Y. Tachi and Y. Morimoto (Poster, March, Osaka)
"三脚型トリヘテロアリール配位子を用いた配位高分子形成過程における多核銅錯体種の置換基効果" 第95化学会春季年会 ○角高海理、西川慶祐、森本善樹、舘祥光 (ポスター、3月、船橋)
"酸素添加酵素を摸倣した非対称構造を有する多核鉄錯体の合成" 第95化学会春季年会 ○中尾拓人、西川慶祐、森本善樹、舘祥光 (口頭、3月、船橋)
"水銀(Ⅱ)トリフラート触媒による新奇環化異性化反応を鍵工程としたレパジホルミン類の合成研究" 第95化学会春季年会 ○山内健吾、菊池正峰、江崎伸之介、小山智之、野久保春華、児玉猛、西川慶祐、舘祥光、森本善樹 (口頭、3月、船橋)
"海洋産紅藻Laurencia viridisから単離された22-ヒドロキシ-15(28)-デヒドロベヌスタトリオールの不斉全合成" 第95化学会春季年会 ○鴇田百栄、滝直人、中井遥、星野晃大、森野光耶子、西川慶祐、舘祥光、森本善樹 (口頭、3月、船橋)
"海洋産細胞毒性ポリエーテルiubolの不斉全合成と立体化学の訂正" 第95化学会春季年会 ○滝直人、鴇田百栄、中井遥、星野晃大、森野光耶子、西川慶祐、舘祥光、森本善樹 (口頭、3月、船橋)
"Synthetic Studies on Tetrodotoxin Model Compound Using Mercury(II) Triflate-catalayzed Novel Cycloisomerization" 第95化学会春季年会 ○T. Maruyama, S. Kikuchi, T. Koyama, K. Nishikawa, Y. Tachi, Y. Morimoto (Oral, April, Funabashi)
"テトロドトキシンの合成研究" 第95化学会春季年会 ○菊池正峰、荒木勇介、丸山高弘、吉山春香、西川慶祐、舘祥光、森本善樹 (口頭、3月、船橋)
”全合成による海洋産細胞毒性ポリエーテルIubolの全立体構造の決定” 第35回有機合成若手セミナー ○滝直人、鴇田百栄、中井遥、星野晃大、森野光耶子、西川慶祐、舘祥光、森本善樹 (ポスター、8月、京都)
"水銀触媒を用いた新奇環化異性化反応によるテトロドトキシン骨格合成法の開発" 第35回有機合成若手セミナー ○丸山高弘、菊池正峰、小山智之、西川慶祐、舘祥光、森本善樹 (ポスター、8月、京都)
"6-epi-テトロドトキシンの全合成研究" 第35回有機合成若手セミナー ○荒木勇介、菊池正峰、丸山高弘、吉山春香、西川慶祐、舘祥光、森本善樹 (ポスター、8月、京都)
"三環性アルカロイドlepadiformines B及びCの全合成研究" 第35回有機合成若手セミナー ○山内健吾、菊池正峰、江崎伸之介、小山智之、野久保春華、西 川慶祐、舘祥光、森本善樹 (ポスター、8月、京都)
"22-Hydroxy-15(28)-dehydrovenustatriolの不斉 全合成と全立体構造の決定" 第35回有機合成若手セミナー ○ 鴇田百栄、滝直人、中井遥、星野晃大、森野光耶 子、西川慶祐、舘祥光、森本善樹 (ポスター、8月、京都)
"水銀(Ⅱ)トリフラート触媒による新奇環化異性化反応を用いた6,6-スピロ環化合物の合成" 第35回有機合成若手セミナー ○吉田浩明、小山智之、西川慶祐、舘祥光、森本善樹 (ポスター、8月、京都)
"着生阻害活性を持つドラスタン型ジテルペンの全合成研究" 第35回有機合成若手セミナー ○福山裕香、西川慶祐、舘祥光、森本善樹 (ポスター、8月、京都)
"着生阻害活性を持つドラスタン型ジテルペンの全合成研究" 第59回香料・テルペンおよび精油化学に関する討論会 ○福山裕香, 西川慶祐, 舘祥光, 森本善樹 (口頭、9月、大阪)
"全合成によるユーボールの構造改訂及び 22-ヒドロキシ-15(28)-デヒドロベヌスタトリオールの全立体構造決定" 第57回天然有機化合物討論会 ○滝直人、鴇田百栄、中井遥、星野晃大、森野 光耶子、児玉猛、西川慶祐、舘祥光、森本善樹 (口頭、9月、横浜)
"密度汎関数法を用いた三脚型トリピリジン-銅系配位高分子生成機構に関する研究" 錯体化学会第65回討論会 ○角高海理、榎本凌、西川慶祐、森本善樹、舘祥光 (ポスター、9月、奈良)
"Asymmetric Total Synthesis of 22-Hydroxy-15(28)-dehydrovenustatrio" 13th International Kyoto Conference on New Aspects of Organic Chemistry (IKCOC-13) ○M. Tokita, N. Taki, H. Nakai, A. Hoshino, M. Morino, K. Nishikawa, Y. Tachi, and Y. Morimoto (Poster, November, Kyoto)
"5,6-Dehydrokawain and synthetic analogs stimulate osteoblastic MC3T3-E1 cells" The 19th Osaka City University International Conference (19th OCUIC) ○M. Kumagai, T. Mishima, A. Watanabe, T. Harada, M. Ide, K. Koizumi, I. Yoshida, K. Fujita, M. Watai, K. Nishikawa and Y. Morimoto (Poster, November, Osaka)
"Asymmetric total synthesis and determination of absolute configuration of heronapyrroles A and B" The 19th Osaka City University International Conference (19th OCUIC) ○S. Hashimoto, T. Matsuo, K. Nishikawa, T. Kodama, S. Kikuchi, Y. Tachi and Y. Morimoto (Poster, November, Osaka)
"Synthesis of 6,6-spiro compound using mercury(II) triflate-catalyzed novel cycloisomerization" The 19th Osaka City University International Conference (19th OCUIC) ○H. Yoshida, T. Koyama, K. Nishikawa, Y. Tachi and Y. Morimoto (Poster, November, Osaka)
"Total syntheses of lepadiformines" The 19th Osaka City University International Conference (19th OCUIC) ○K. Yamauchi, S. Kikuchi, S. Ezaki, T. Koyama, K. Nishikawa, Y. Tachi and Y. Morimoto (Poster, November, Osaka)
"Studies on total synthesis of (-)-histrionicotoxin" The 19th Osaka City University International Conference (19th OCUIC) ○K. Matsumura, K. Nishikawa, Y. Tachi and Y. Morimoto (Poster, November, Osaka)
"ヘロナピロール A 及び B の不斉全合成と全立体化学の決定" 第45回複素環化学討論会 ○橋本統星、松尾知樹、西川慶祐、児玉猛、菊池正峰、舘祥光、森本善樹 (ポスター、11月、東京)
"水銀トリフラート触媒による環化異性化反応を用いたレパジホルミン類の全合成研究" 第45回複素環化学討論会○山内健吾、菊池正峰、江崎伸之介、小山智之、西川慶祐、舘祥光、森本善樹 (口頭、11月、東京)
"Comparison of Vanadium Dependent Bromoperoxidases from Three Species of the Red Algal Genus Laurencia" The International Chemical Congress of Pacific Basin Societies 2015 (Pacifichem 2015) K. Kaneko, K. Washio, D. Kobayashi, T. Ishikawa, T. Umezawa, F. Matsuda, K. Nishikawa, Y. Morimoto, M. Morikawa, and ○T. Okino (Oral, December, Hawaii)
"Aculeatin and Toddaculin from Toddalia Asiatica (L.) Lam. Suppress Lipopolysaccharide Induced Inflammation of RAW264 Macrophages through Different Modes of Action" The International Chemical Congress of Pacific Basin Societies 2015 (Pacifichem 2015) ○M. Kumagai, A. Watanabe, T. Mishima, I. Yoshida, K. Koizumi, M. Ide, K. Fujita, M. Watai, K. Nishikawa, and Y. Morimoto (Oral, December, Hawaii)
"Evaluation of the Action of the Solvent Molecules to the Weak Interaction Between the Large-sized γ-Cyclodextrin and the Chiral Lipoic Acid" The International Chemical Congress of Pacific Basin Societies 2015 (Pacifichem 2015) ○M. Doe, K. Nishikawa, Y. Tachi, and Y. Morimoto (Poster, December, Hawaii)
"Synthetic Studies on Tetrodotoxin Model Compound Using Mercury(II) Triflate-catalyzed Novel Cycloisomerization" The International Chemical Congress of Pacific Basin Societies 2015 (Pacifichem 2015) ○T. Maruyama, S. Kikuchi, T. Koyama, K. Nishikawa, Y. Tachi, and Y. Morimoto (Poster, December, Hawaii)
"Studies on the Formation Process of Coordination Polymers for Photoluminescent Material" The International Chemical Congress of Pacific Basin Societies 2015 (Pacifichem 2015) ○K. Kakutaka, K. Nishikawa, Y. Morimoto, and Y. Tachi (Poster, December, Hawaii)
"Total Syntheses of Lepadiformines Using Hg(OTf)2-catalyzed Novel Cycloisomerization" The International Chemical Congress of Pacific Basin Societies 2015 (Pacifichem 2015) ○K. Nishikawa, K. Yamauchi, S. Kikuchi, S. Ezaki, T. Koyama, T. Kodama, Y. Tachi, and Y. Morimoto (Poster, December, Hawaii)
このページの先頭へ

2014年 (平成26年)
"水銀トリフラート触媒による新奇環化異性化反応を鍵工程としたアザ三環性アルカロイド(-)-レパジホルミンAの全合成" 第94化学会春季年会
○菊池正峰、江崎伸之介、小山智之、野久保春華、児玉猛、西川慶祐、舘祥光、森本善樹 (口頭、3月、名古屋)
"デヒドロチルシフェロールとその類縁体の全合成研究" 第94化学会春季年会 ○中井遥、星野晃大、森野光耶子、神原瞳、滝直人、西川慶祐、舘祥光、森本善樹 (口頭、3月、名古屋)
"三脚型ヘテロトリアリール配位子を用いた錯体形成過程におけるコア構造の効果" 第94化学会春季年会 ○角高海理、西川慶祐、森本善樹、舘祥光 (口頭、3月、名古屋)
"ジプロリン骨格を有する新規鉄錯体の合成と機能" 第94化学会春季年会 ○山口颯人、西川慶祐、森本善樹、舘祥光 (口頭、3月、名古屋)
"三脚型トリヘテロアリール配位子を用いた配位高分子形成過程の解明" 第94化学会春季年会 ○田村哲平、西川慶祐、森本善樹、舘祥光 (口頭、3月、名古屋)
"L-prolineから誘導される不斉配位子を導入した鉄錯体の電気化学的な酸化反応の検討" 第94化学会春季年会 ○溝口晃平、西川慶祐、森本善樹、舘祥光 (口頭、3月、名古屋)
"テトロドトキシンの合成研究” 第34回有機化学若手セミナー ○菊池正峰、吉山春香、西川慶祐、舘祥光、森本善樹 (ポスター、8月、大阪)
”海洋産細胞毒性ポリエーテルiubol推定構造式の不斉全合成” 第34回有機合成若手セミナー ○滝直人、中井遥、星野晃大、森野光耶子、西川慶祐、舘祥光、森本善樹
(ポスター、8月、大阪)
”水銀(Ⅱ)トリフラート触媒を用いた新奇環化異性化反応によるテトロドトキシンモデル化合物の合成研究” 第34回有機合成若手セミナー ◯丸山高弘、菊池正峰、小山智之、西川慶祐、舘祥光、森本善樹 (ポスター、8月、大阪)
”水銀(Ⅱ)トリフラート触媒を用いた新奇環化異性化反応によるテトロドトキシンモデル化合物の合成研究” 第44回複素環化学討論会 ◯丸山高弘、菊池正峰、小山智之、西川慶祐、舘祥光、森本善樹 (ポスター、9月、札幌)
”海洋産細胞毒性ポリエーテルiubol推定構造式の不斉全合成” 第44回複素環化学討論会 ○滝直人、中井遥、星野晃大、森野光耶子、西川慶祐、舘祥光、森本善樹
(口頭、9月、札幌)
"α-リポ酸光学異性体/γ-シクロデキストリン包接複合体の溶液中での挙動" 第31回シクロデキストリンシンポジウム ○土江松美、西川慶祐、舘祥光、森本善樹 (ポスター、9月、島根)
"非対称型配位子を用いた多核鉄錯体の構造及びその反応性" 錯体化学会第64回討論会 ○中尾拓人、舘祥光、森本善樹、西川慶祐 (ポスター、9月、東京)
"三脚型トリへテロアリール配位子を用いた銅錯体形成過程の構造解明” 錯体化学会第64回討論会 ○角高海理、田村哲平、西川慶祐、森本善樹、舘祥光
(口頭、9月、東京)
"4‒ファルネシル-2-ニトロピロール天然物の全合成” 第56回天然有機化合物討論会 松尾知樹、三谷光、○児玉猛、西川慶祐、舘祥光、森本善樹
(ポスター、10月、高知)
"水銀トリフラート触媒による新奇環化異性化反応を鍵工程とした(-)-レパジホルミンAの全合成" 第106回有機合成シンポジウム(秋)
◯菊池正峰、江崎伸之介、小山智之、野久保春華、児玉猛、西川慶祐、舘祥光、森本善樹 (口頭及びポスター、11月、東京)
このページの先頭へ

2013年 (平成25年)
"非対称ペンタピリジン配位子を導入した新規鉄錯体の合成" 第93化学会春季年会 ○中尾拓人、森本善樹、舘祥光 (口頭、3月、草津)
"α位置換金属フタロシアニンの合成" 第93化学会春季年会 ○青柳貞利、森本善樹、舘祥光 (口頭、3月、草津)
"イソデヒドロチルシフェロールの収束的な全合成" 第93化学会春季年会 ○中井遥、星野晃大、森野光耶子、神原瞳、児玉猛、菊池正峰、舘祥光、森本善樹
(口頭、3月、草津)
"仮想生合成経路に基づく(+)-エケベリンD4の全合成研究" 第93化学会春季年会 ○児玉猛、青木慎悟、松尾知樹、舘祥光、森本善樹
(口頭、3月、草津)
"ヘロナピロールA 及びB の全合成" 第93化学会春季年会 ○松尾知樹、三谷光、児玉猛、舘祥光、森本善樹 (口頭、3月、草津)
"ニトロピロリン類の合成研究" 第93化学会春季年会 ○三谷光、松尾知樹、児玉猛、舘祥光、森本善樹 (口頭、3月、草津)
"金属触媒を用いた新奇環化異性化反応によるテトロドトキシンの合成研究" 第93化学会春季年会 ○菊池正峰、吉山春香、小山智之、舘祥光、森本善樹
(口頭、3月、草津)
"神経毒性テトロドトキシンの合成研究" 第93化学会春季年会 ○吉山春香、小山智之、菊池正峰、舘祥光、森本善樹 (口頭、3月、草津)
"(-)-レパジホルミン A の合成研究" 第93化学会春季年会 ○江崎伸之介、小山智之、舘祥光、森本善樹 (口頭、3月、草津)
"ヘロナピ ロール類A及びBの全合成と全立体構造の決定" 第33回有機化学若手セミナー ○松尾知樹、三谷光、児玉猛、西川慶祐、舘祥光、森本善樹
(ポスター、8月、神戸)
"海洋産含臭素化合物isodehydrothyrsiferolの全合成と全立体構造の決定" 第33回有機合成若手セミナー
○中井遥、星野晃大、森野光耶子、神原瞳、児玉猛、菊池正峰、西川慶祐、舘祥光、森本善樹 (ポスター、8月、神戸)
"水銀トリフラート触媒による新奇環化異性化反応を鍵工程とした(-)-レパジホルミンAの全合成" 第33回有機合成若手セミナー
○菊池正峰、江崎伸之介、 小山智之、野久保春華、児玉猛、西川慶祐、舘祥光、森本善樹 (ポスター、8月、神戸) 優秀研究発表賞
"イノラートを用いた環化反応を鍵反応としたstemonamineの全合成" 第33回有機合成若手セミナー ○西川慶祐、池永大、松本健司、新藤充
(ポスター、8月、神戸)
"α-リポ酸シクロデキストリン包接複合体の溶液中での挙動" 第30回シクロデキストリンシンポジウム ○土江松美、河井昌裕、西川慶祐、舘
祥光、森本善樹 (ポスター、9月、熊本)
"水銀トリフラート触媒による新奇環化異性化反応を鍵工程としたアザ三環性アルカロイド(-)-レパジホルミンAの全合成" 第55回天然有機化合物討論会 ○菊池正峰、江崎伸之介、小山智之、野久保春華、児玉猛、西川慶祐、舘祥光、森本善樹 (口頭、9月、京都)
"L-prolineから誘導される新規不斉合成触媒の合成と酸化反応活性の検討" 錯体化学会第63回討論会 〇溝口晃平、西川慶祐、森本善樹、舘祥光
(口頭、11月、沖縄)
"非対称ペンタピリジン配位子を用いた鉄錯体の合成と構造及びその反応性" 錯体化学会第63回討論会 〇中尾拓人、西川慶祐、森本善樹、舘祥光
(口頭、11月、沖縄)
"不均一な配位場を有する三脚型配位子を用いた配位高分子合成と発光特性" 錯体化学会第63回討論会 〇田村哲平、西川慶祐、森本善樹、舘祥光
(ポスター、11月、沖縄)
"ヘロナピ ロール類A及びBの全合成と全立体構造の決定" 化学人材育成プログラム学生・企業交流会 ○松尾知樹、三谷光、児玉猛、西川慶祐、舘祥光、森本善樹
(ポスター、12月、大阪)
