CMP キナーゼの基質結合に伴う構造変化
タンパク質とリガンドとの結合は,多様な細胞活動における分子認識の基盤である。NMR による立体構造解析や分子シミュレーションなど多くの研究により,その結合メカニズムとして induced fit (誘導適合) 機構と conformational selection (構造選択) 機構という 2 つのモデルが提唱されている。後者のモデルでは,リガンド結合の有無に関わらず,open form と closed form を含む構造アンサンブルが存在し,その中から適した構造が選択されると考える。しかし,この 2 つを実験的に区別することは一般的には困難である。また,構造選択機構を支持するリガンド非結合時の closed form やリガンド結合時の open form の存在を実験的に示した研究は非常に少ない。本研究では,ATP によって CMP をリン酸化する CMP kinase (CMPK) の X 線結晶構造解析を行い,リガンド結合に伴う構造変化を明らかにした。まず大腸菌で発現させた高度好熱菌 Thermus thermophilus HB8 由来 CMPK を調製した。リガンド非結合型の構造は SeMet 体の結晶を用いた SAD 法により決定した。その他のリガンド結合複合体 (4 種類) の構造は soaking あるいは共結晶化によって結晶を得て,分子置換法により決定した。2 つのリガンドが CMPK に結合した三者複合体の構造は,本研究で初めて決定した。
CMPK の立体構造は CORE,NMP-binding domain (NMB-bd),LID の 3 つのドメインからなる。リガンド非結合型の全体構造は,NMP-bd と LID が CORE から離れた open form であった。CMP complex (closed) は,NMP-bd と LID がドメイン単位で CORE の方向に動いて基質結合部位が閉じた closed form をとっていた。CMP は NMP-bd と CORE からのアミノ酸残基によって認識されていた。しかし,CMP complex (open) では,CMP が NMP-bd に結合しているにもかかわらず open form であるという予想外の構造が得られた。さらに,CDP-ADP-Gd complex では,全体構造は closed form だが,LID 内の複数のアミノ酸残基側鎖が CMP-Mg complex での位置から大きく動いて CMP や ADP と相互作用していた。また,CDP complex の構造は CMP-Mg complex とほぼ同一であった。これらの結果から,CMPK とリガンドとの結合においては,誘導適合機構と構造選択機構の 2 つの仕組みが共存して働いている可能性が示唆された。
・Meta et al. (2020) PLoS ONE, 15(5), e0233689
https://doi.org/10.1371/journal.pone.0233689
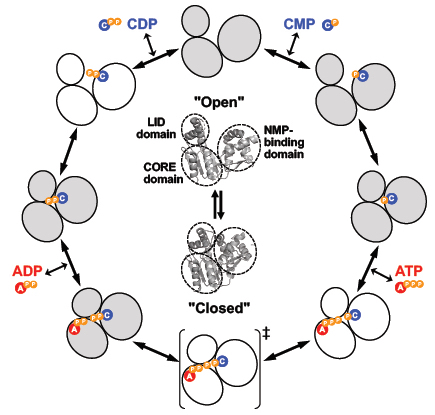
図 T. thermophilus CMP キナーゼの反応サイクルに伴うコンフォメーション変化の模式図
本研究で結晶構造を決めたものを薄く灰色をつけて示す。