リン酸化を介した TkaP の DNA 結合活性の制御機構
翻訳後修飾の一つである Ser, Thr, Tyr の可逆的なリン酸化は,真核生物だけでなく原核生物においても細胞内の情報伝達に関わっている。我々は,高度好熱菌 Thermus thermophilus HB8 のリン酸化タンパク質として同定した TkaP が,protein kinase TpkA によってリン酸化されることを明らかにしている。しかし,TkaP は既知のタンパク質とは有意な配列類似性を持たず,その立体構造や機能は不明である。そこで本研究では,X 線結晶解析法により TkaP の立体構造を決定し,変異体解析による分子機能の解析を行った。TkaP の N 末端領域の構造は,ribbon-helix-helix (RHH) 型の DNA 結合タンパク質と類似しており,DNA 結合部位も RHH 型タンパク質と共通していた。しかし,TpkA による Ser 残基のリン酸化によって TkaP の DNA 結合は阻害された。さらに,TkaP に特有の C 末端領域を欠失させると,リン酸化されても DNA との結合能を失わなかった。これらの結果から,TkaP は C 末端領域を介してリン酸化によって DNA 結合を調節する,新奇な RHH 型 DNA 結合タンパク質であることが示唆された。
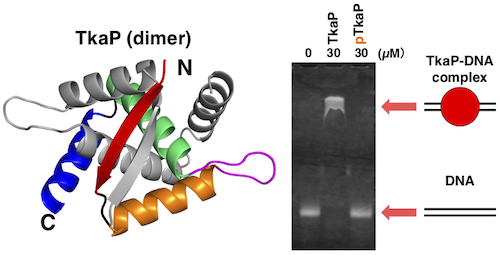
図 TkaP の結晶構造と DNA 結合活性
左図では一方のサブユニットだけを着色した。右図の pTkaP はリン酸化されていることを示す。